Vol 6 No 1 2021 – 7
INVESTIGATION / RESEARCH
Remoción de cinco productos farmacéuticos catalogados como contaminantes emergentes en medio acuoso utilizando la especie vetiver (Chrysopogon zizanioides)
Removal of five pharmaceutical products classified as emerging pollutants in aqueous medium using the vetiver species (Chrysopogon zizanioides)

Checa-Artos Miriam1, Sosa del Castillo Daynet1, Vanegas María Eulalia3, Ruiz-Barzola Omar1,2, Barcos-Arias Milton1*
Available from: http://dx.doi.org/10.21931/RB/2021.06.01.7
RESUMEN
Los productos farmacéuticos constituyen un grupo único de contaminantes emergentes de gran interés, debido a que se ha determinado su presencia frecuente en aguas superficiales, subterráneas y agua potable. Debido al metabolismo y la absorción incompletos en el organismo humano, una cantidad significativa de estos fármacos se excretan y liberan al ambiente a través de las aguas residuales. Por lo que el objetivo de este trabajo fue evaluar el potencial de la especie vetiver (Chrysopogon zizanioides) para eliminar del medio acuoso cinco productos farmacéuticos comúnmente recetados y de venta libre como ciprofloxacina, ibuprofeno, sulfametaxazol, diclofenaco y acetaminofén. La especie fue aclimatada en invernado, donde se llevó a cabo los experimentos en condiciones controladas de temperatura y a un pH de 6,5. Las muestras fueron analizadas utilizando espectrofotometría UV-Vis para leer en forma directa las absorbancias de cada producto farmacéutico. Para el análisis estadístico de los datos se empleó la metodología de superficies de respuesta con el fin de encontrar los modelos que ayuden a determinar tiempos y concentraciones óptimas donde se maximiza la absorción de cada fármaco, así como la obtención de las pendientes de crecimiento para determinar hacia donde se deberá buscar el óptimo. Se utilizó el software estadístico R versión 3.6.0 y RStudio versión 1.1.453.
Los resultados obtenidos indican que C. zizanioides removió de manera más eficiente ciprofloxacina (98,3%) a una concentración de 3mg/L en un tiempo de 149h, seguido por ibuprofeno y diclofenaco con un máximo de remoción de 73,33% y sulfametaxazol con 66,53%, obteniéndose el menor porcentaje de remoción para acetaminofén de 38,49% a las 192h, donde se realizó toma de muestras cada 48 horas de las soluciones de cada fármaco a diferentes concentraciones (3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L).
En este trabajo de investigación se demostró la capacidad removedora de Chrysopogon zizanioides de los cinco fármacos estudiados en medio acuoso en condiciones controladas, vislumbrando un gran potencial en el ámbito de la biotecnología ambiental para el tratamiento terciario de aguas residuales.
Palabras clave: Productos farmacéuticos, contaminantes emergentes, aguas residuales, vetiver (Chrysopogon zizanioides), fitorremediación, superficie de respuesta.
ABSTRACT
Pharmaceutical products constitute a unique group of emerging pollutants of great interest because their frequent presence in surface waters, groundwater, and drinking water have been determined. Due to incomplete metabolism and absorption in the human body, many of these drugs are excreted and released to the environment through wastewater. Therefore, this work’s objective was to evaluate the potential of the vetiver species (Chrysopogon zizanioides) to eliminate five commonly prescribed and over-the-counter pharmaceuticals from the aquatic environment, such as ciprofloxacin, ibuprofen, sulfamethoxazole, diclofenac, and acetaminophen. The species was acclimated in wintering to carry out the experiments under standard temperature conditions and a pH of 6.5. The samples were analyzed using UV-Vis spectrophotometry to read the absorbances of each pharmaceutical product directly. For the statistical analysis of the data, the response surfaces methodology was used to find the models that help determine optimal times and concentrations where the absorption of each drug is maximized and obtain the growth slopes to determine where the optimum should be sought. Statistical software R version 3.6.0 and RStudio version 1.1.453 were used.
The results obtained indicate that C. zizanioides more efficiently removed ciprofloxacin (98.3%) at a concentration of 3mg/L over a time of 149h, followed by ibuprofen and diclofenac with a maximum removal of 73.33% and sulfametaxazole with 66.53%, obtaining the lowest percentage of removal for acetaminophen of 38.49% at 192h, where samples were taken every 48 hours of the solutions of each drug at different concentrations (3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L).
In this research work, the removal capacity of Chrysopogon zizanioides of the five drugs studied in an aqueous medium under controlled conditions was demonstrated, envisaging great potential in the field of environmental biotechnology for tertiary wastewater treatment.
Keywords: Pharmaceuticals products, emerging pollutants, wastewater, vetiver (Chrysopogon zizanioides), phytoremediation, response surface.
INTRODUCCIÓN
Los contaminantes emergentes (CE) son compuestos que actualmente no están incluidos en las regulaciones de calidad del agua, sin embargo, presentan amenazas potenciales para los ecosistemas acuáticos, la salud y la seguridad humana. Abarcan un grupo diversos de compuestos que incluyen a productos farmacéuticos (PFs), drogas de abuso, productos de cuidado personal (PCP), esteroides y hormonas, tensioactivos, compuestos per fluorados (PFC), llama retardantes, aditivos industriales y agentes aditivos de gasolina, así como sus productos de transformación, nanomateriales, 1,4-dioxano y subproductos de desinfección de piscinas (DBP)1,2,3.
Los PFs se caracterizan por el uso extenso en medicina humana y veterinaria y están conformados por diversos grupos de compuestos como antibióticos, analgésicos, antinflamatorios, antidepresivos, drogas de abuso, antidiabéticos, suplementos alimenticios, entre otros. La gran mayoría se excreta sin metabolizar después de su aplicación, llegando así a las aguas residuales4,5.
La presencia de PFs en el ciclo del agua se ha reportado en todo el mundo. Su detección ha suscitado preocupación, ya que se ha determinado su presencia en efluentes de plantas de tratamiento de aguas residuales, en aguas superficiales (ríos, manantiales, lagunas, lagos y mares), aguas subterráneas e incluso en sistemas de tratamiento de agua potable6,7,8,9,10,11,12,13.
Una investigación llevada a cabo por el Servicio Geológico de los Estados Unidos en 2002 fue el primer estudio de reconocimiento para demostrar la gran cantidad de PFs, hormonas esteroides y otros3,14
La aparición y el destino de los PFs y sus metabolitos en el medio acuático han sido reconocidos como un problema emergente, debido a que se sabe poco con respecto a los posibles efectos de estos compuestos en organismos vivos, principalmente la toxicidad crónica y posibles efectos aditivos de una amplia gama de PFs presentes en el ambiente acuático, inclusive a muy bajas concentraciones (ng/ L y µg/L)15,16.
Los PFs más prescritos en medicina humana son los analgésicos antiinflamatorios como el ibuprofeno y el diclofenaco, los antiepilépticos como la carbamazepina, antibióticos como la amoxicilina y el sulfametoxazol, y los bloqueantes como el metoprolol, además de los fármacos cada vez más utilizados en veterinaria, acuicultura, ganadería y avicultura17.
Los ingredientes farmacéuticos activos se detectan cada vez más en el medio ambiente debido a varios factores, incluidos los avances en las prácticas médicas humanas y veterinarias, y la mejora de la sensibilidad de la instrumentación analítica.
La presencia de PFs en el agua podría fomentar la diseminación de los genes de resistencia a los antibióticos, que pueden interactuar con la flora intestinal, lo que podría afectar la salud humana18. Los antibióticos constituyen un importante contaminante del agua y pueden alterar o influir selectivamente en la función de otros organismos en concentraciones bajas.
Por otro lado, la irrigación con agua que contiene PFs podría implicar que los cultivos puedan absorber estos compuestos, siendo otra ruta de exposición humana19.
Un proyecto realizado por la Agencia Federal Alemana del Medio Ambiente (UBA), recopila datos publicados en el ámbito mundial sobre concentraciones medidas de PF. Los resultados ilustran que las concentraciones acuáticas detectadas a escala global son comparables con las encontradas en Europa. Se ha demostrado que más de 600 sustancias farmacéuticas están presentes en el medio ambiente en todo el mundo20.
China tiene la mayor población y cantidad de fabricantes farmacéuticos del mundo. En 2011, produjo más de 1500 tipos de PFs. Los ingredientes activos locales se produjeron en China, y el estimado y la producción nacional fue de aproximadamente 2,000,000 toneladas21.
Existen estudios alrededor del planeta, que han detectado la presencia de contaminantes emergentes a la entrada y salida de las plantas de tratamiento de aguas residuales convencionales, lo que presupone que no están diseñadas para el tratamiento de este tipo de contaminantes. En un estudio realizado en Algeria, se reportó la presencia de ibuprofeno, naproxeno y diclofenaco en aguas superficiales; ibuprofeno y ketofreno en agua de grifo, confirmando la incapacidad de una planta de tratamiento de aguas residuales (PTAR) clásica para eliminar estos contaminantes22.
Otro estudio realizado en la India muestra que tanto aguas superficiales como subterráneas están contaminadas con más de 15 contaminantes emergentes (Fármacos, productos de aseo personal y edulcorantes artificiales), poniendo en riesgo la salud de 600 millones de personas que habitan en la cuenca del río Ganges23.
Según24, las características de la calidad del agua y los contaminantes orgánicos emergentes fueron muestreados en Ecuador, a lo largo de los ríos San Pedro – Guayllabamba – Esmeraldas y sus principales afluentes en el verano de 2013. Los principales compuestos detectados fueron venlafaxina, carbamazepina, sulfametoxazol y benzoilcgonina. El estudio permitió relacionar el consumo de fármacos en una de las principales ciudades (Quito) de América Latina y permitió mostrar que el consumo de la mayoría de las drogas muestreadas (carbamazepina, venlafaxina, O-des metil venlafaxina, sulfametoxazol, etinilestradiol) estuvo por debajo de su nivel de consumo promedio en Europa, Israel y América del Norte24.
En varias investigaciones realizadas en todo el mundo, los fármacos de estudio acetaminofén, ibuprofeno, diclofenaco, sulfametaxazol y ciprofloxacina han sido detectados en aguas superficiales3,6,7,25,26; en aguas subterráneas8,23,27,28,29; en aguas residuales9,10,11,12,30,31,32,33,34,35,36; en agua potable13,37,38.
Los desafíos más críticos de las cuencas urbanas son suministrar agua dulce de buena calidad a las ciudades y eliminar las aguas residuales sin poner en peligro los recursos hídricos y el medio ambiente, dado que la exposición a contaminantes de preocupación emergente incluye el desarrollo de resistencia a antibióticos, alteración endócrina y la carcinogenicidad. Por lo tanto, comprender la ocurrencia y distribución de contaminantes orgánicos complejos ayuda a predecir y mitigar sus posibles efectos sobre la salud ecológica y humana en los ambientes acuáticos39.
Por lo expuesto, es necesario investigar tratamientos alternativos sostenibles, de bajo costo y de alto porcentaje de remoción de estos contaminantes emergentes, que pudieran constituir un tratamiento terciario de aguas residuales, tal es el caso de la fitorremediación.
El interés en la fitorremediación como método para resolver la contaminación ambiental ha estado creciendo rápidamente en los últimos años. Esta tecnología verde que involucra «plantas tolerantes» se ha utilizado para limpiar el suelo y el agua subterránea de metales pesados y otros compuestos orgánicos tóxicos. La fitorremediación implica el cultivo de plantas en una matriz contaminada para eliminar contaminantes ambientales, facilitando el secuestro y / o degradación (desintoxicación) de los contaminantes40.
La fitorremediación proporciona una alternativa segura y económica en comparación con los métodos de tratamiento físico y químico y se ha aceptado como una de las mejores prácticas de gestión para varios servicios de gestión ambiental41.
La fitorremediación utiliza mecanismos de las plantas para remediar ambientes contaminados, como la fito-extracción, rizo-filtración, fito-estabilización, fito-degradación y fito-volatización. Estos procesos contribuyen a la remediación, desintoxicación, lixiviación, contención y estabilización de contaminantes40,42.
La selección de la especie vetiver (Chrysopogon zizanioides) para la presente investigación, se basó en el alto número de reportes científicos que denotan la efectividad que tiene esta especie removiendo diferentes tipos de contaminantes como metales pesados y algunos contaminantes orgánicos, indicando que estas técnicas son rentables en comparación con otros métodos40,43,44.
Las principales ventajas de Chrysopogon zizanioides están relacionadas con su sistema radicular fibroso masivo y la rápida tasa de producción de biomasa de hasta 354 kg/Ha en seis meses, lo que la convierte en una especie versátil para diferentes usos como, estabilización de taludes, rehabilitación de ambientes contaminados, tratamiento de aguas residuales, tratamiento de drenaje ácido de minas, fitoextracción de metales y de algunos compuestos orgánicos41,45,46,47.
Este trabajo de investigación tiene como objetivo principal contribuir con una técnica probada en laboratorio para la remoción de los contaminantes emergentes acetaminofén, ciprofloxacina, diclofenaco, sulfametoxazol e ibuprofeno por medio de fitorremediación, utilizando la especie vetiver (Chrysopogon zizanioides), lo que podría servir de base en el mediano plazo para el desarrollo de sistemas de tratamiento terciario de aguas residuales que eliminen estos contaminantes en el medio acuático.
MATERIALES Y MÉTODOS
Recolección y acondicionamiento de la especie vetiver (Chrysopogon zizanioides)
Las plántulas de la especie vetiver (Chrysopogon zizanioides), fueron recolectadas y sembradas en un vivero ubicado en la ciudad de Milagro, provincia del Guayas por un tiempo aproximado de dos meses y luego fueron llevadas al invernadero del Centro de Investigaciones Biotecnológicas del Ecuador (CIBE) de la Escuela Superior Politécnica del Litoral (ESPOL), en donde se las dispuso en terrenos aledaños al invernadero durante aproximadamente 30 días. Posteriormente se realizó un lavado a fondo para eliminar todo el suelo e impurezas de la zona radicular y se procedió a transferir las plantas a canastillas rectangulares de 25 litros de capacidad para ser aclimatadas en agua durante 20 días, previo a su uso en los experimentos de fitorremediación de los productos farmacéuticos en estudio. Este es un proceso adaptado en base a lo establecido por48.
Diseño del experimento
Se estudiaron cinco PFs de manera independiente: sulfametoxazol, ciprofloxacina, acetaminofén, ibuprofeno y diclofenaco todos de la marca SIGMA-ALDRICH de 99,9 % de pureza. De cada fármaco se prepararon soluciones acuosas utilizando metanol ultrapuro de la marca Merck a cuatro concentraciones: 3 mg/L, 6 mg/L, 9 mg/L, 12 mg/L. Se utilizaron 4 tiempos de muestreo 48 h, 96 h, 144 h y 192 h, para obtener la variable de respuesta que es el porcentaje de remoción.
Se colocaron dos unidades experimentales de dos litros de solución de cada PFs y por cada concentración seleccionados para esta investigación, luego se introdujo la especie vetiver (Chrysopogon zizanioides) con un peso aproximado de 60 g. Los ensayos fueron mantenidos a una temperatura de 25oC y un pH de 6,5 durante todo el experimento. Una vez concluido el tiempo del ensayo se procedió a recolectar con una micropipeta tres alícuotas de 2 ml de cada unidad experimental. El volumen recolectado fue colocado en tubos eppendorf y almacenados a temperatura de refrigeración hasta su posterior análisis.
Se utilizó el diseño factorial, con dos puntos internos; Concentración (C) y Tiempo (T), siendo estos los factores; los niveles considerados se indican en la figura 1.

Figura 1. Esquema del diseño experimental utilizado
Para medir la variable de respuesta, porcentaje de remoción del PF, previamente se midió por triplicado la absorbancia de cada uno de los PFs utilizando la técnica de espectrofotometría de luz Uv visible.
Para determinar el porcentaje de remoción de los compuestos en estudio se aplicó la siguiente fórmula:

Análisis de Datos
Para el análisis estadístico de los datos se empleó la técnica de superficies de respuesta para encontrar los modelos que ayuden a determinar tiempos y concentraciones óptimas donde se maximiza la absorción de cada fármaco, así como la obtención de las pendientes de crecimiento para determinar hacia donde se deberá buscar el óptimo, en los casos donde no se los encontró. Se utilizó el software estadístico R versión 3.6.0 y RStudio versión 1.1.453.
RESULTADOS
Modelo General
El modelo general de la superficie de respuesta está representado por la ecuación (1):

Donde,
Y= porcentaje de remoción
bo= intercepto
bi= coeficientes del modelo
C = Concentración
T = Tiempo
La matriz resultante no permitió obtener un modelo polinómico de grado 2 para ambos factores a la vez, por lo que se desarrolló un modelo con forma cuadrática para un factor, mientras se mantuvo la linealidad en el otro factor según las ecuaciones (2), (3).

Tabla 1.- Modelo general de superficie de respuesta para cada uno de los fármacos de estudio.

Figura 2.- Resultados obtenidos con la técnica superficie de respuesta para la remoción con Chrysopogon zizanioides de los fármacos A) sulfametoxazol, B) ciprofloxacina, C) ibuprofeno, D) diclofenaco y E) acetaminofén en medio acuoso a concentraciones de 3 mg/L, 6 mg/L, 9 mg/L y 12 mg/L, durante cuatro tiempos de muestreo 48 h, 96 h, 144 h y 192 h.
En el modelo obtenido para sulfametaxazol (Figura 2A), los coeficientes de la variable C, T y T2, fueron significativos por lo que se pudo reducir el modelo para obtener más información eliminando el término no significativo, el cual resulta de la interacción entre las variables de concentración y tiempo, según la ecuación (4).
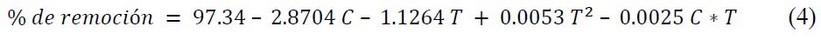
En el rango estudiado, para el fármaco sulfametoxazol, inicia con un porcentaje de remoción de 46,52%, a una concentración de 3mg/L en un tiempo de 48h, dicho porcentaje presenta un descenso en las primeras 105h; a partir de ese tiempo se observa que el porcentaje de remoción tiene un ascenso más pronunciado, alcanzando un máximo de remoción de 66.53%, a la concentración de 3mg/L en un tiempo de 192h; sin embargo, se observa que el óptimo aún está alejado de este rango y al analizar el ascenso más pronunciado, se visualiza que para encontrar el óptimo sería necesario reducir las concentraciones e incrementar el tiempo, se puede considerar también la posibilidad de encontrar el óptimo en la reducción de tiempo y de concentración.
Para la ciprofloxacina (Figura 2B), el modelo responde de manera similar al modelo del sulfametaxazol, donde tenemos la ecuación (5):

En el rango estudiado, para la ciprofloxacina se observa que el porcentaje de remoción parte con un 79.05%, en una concentración de 3 mg/L en un tiempo de 48h, este porcentaje logra alcanzar un máximo de remoción de 98.32% a las 149h, al alcanzar este máximo, se produce el proceso inverso y el porcentaje de remoción comienza a reducirse, se observa que para alcanzar el óptimo es necesario reducir las concentraciones manteniendo el tiempo de 149h.
En el modelo estudiado para el ibuprofeno (Figura 2C), los valores de las variables C, T, T2 y C*T, son significativos por lo que se presenta un modelo que obtiene la mayor información, acorde a la ecuación (6).

El ibuprofeno inicia con un porcentaje de remoción de 17.00%, a una concentración de 3mg/L en un tiempo de 48h, dicho porcentaje presenta un ascenso pronunciado alcanzando un máximo de remoción de 73.33%, a una concentración de 12mg/L en un tiempo de 192h; sin embargo, se observa que el óptimo aún está alejado de este rango y al analizar el ascenso más pronunciado, se observa que para encontrar el óptimo es necesario aumentar las concentraciones e incrementar el tiempo.
En el modelo estudiado para el diclofenaco (Figura 2D), los valores de la variable C, T y T2 son significativos por lo que se puede reducir el modelo para obtener más información eliminando el término que no es significativo, el cual resulta de la interacción entre las variables de concentración y tiempo, como se observa en la ecuación (7).

En el caso del diclofenaco inicia con un porcentaje de remoción de 28.18%, con una concentración de 3 mg/L en un tiempo de 48h, dicho porcentaje presenta un descenso en las primeras 106h; a partir de ese tiempo se observa que el porcentaje de remoción tiene un ascenso alcanzando un máximo de remoción de 73.33%, con una concentración de 12mg/L en un tiempo de 192h; sin embargo, se observa que el óptimo aún está alejado de este rango y al analizar el ascenso más pronunciado, vemos que para encontrar el óptimo sería necesario aumentar las concentraciones e incrementar el tiempo.
En el modelo estudiado para el acetaminofén (Figura 2E), se comporta de manera similar a lo presentado en los otros fármacos, tal como lo muestra la ecuación (8)

El acetaminofén inicia con un porcentaje de remoción de 14.33%, a una concentración de 3 mg/L en un tiempo de 48h, dicho porcentaje presenta un descenso lento en las primeras 91h; a partir de ese tiempo se observa que el porcentaje de remoción tiene un ascenso alcanzando un máximo de remoción de 38.49%, con una concentración de 3mg/L en un tiempo de 192h; sin embargo, se observa que el óptimo aún está alejado de este rango y al analizar el ascenso más pronunciado, vemos que para encontrar el óptimo es necesario reducir las concentraciones e incrementar el tiempo. También se podría considerar la posibilidad de encontrar el óptimo reduciendo el tiempo y la concentración.
DISCUSIÓN
Los resultados obtenidos en esta investigación demostraron la capacidad de Chrysopogon zizanioides para remover los cinco fármacos estudiados en medio acuoso en un periodo experimental de 192 h a diferentes concentraciones consideradas en esta investigación (3, 6, 9 y 12 mg/L).
Los valores obtenidos para el sulfametoxazol alcanzaron un porcentaje máximo de 66.53% a las 192 h (Figura 2A), valor de remoción que resulta no óptimo.
Al analizar el ascenso de la curva de absorción, se visualiza que para encontrar el óptimo sería necesario reducir las concentraciones e incrementar el tiempo. Sin embargo, los valores de absorción del sulfametoxazol resultan semejantes a los reportados en otros estudios. Se ha registrado un porcentaje de remoción de alrededor del 19.0% únicamente después de 24 h de exposición en plantas de col china y espinaca de agua con soluciones de sulfametoxazol a una concentración de 100 mg/L49
Al analizar las muestras correspondientes a la ciprofloxacina se obtuvieron valores óptimos del 98.32% a las 149 h (Figura 2B) con una concentración de 3 mg/L, estos resultados son similares a un estudio donde se alcanzó una remoción del 97.0% de ciprofloxacina en un período experimental de 30 días, en plantas expuestas a 0,05 y 0,1 mg/L de este antibiótico, y 80.0% y 85.0% de remoción respectivamente al ser expuestas a soluciones con concentraciones de 1 a 10 mg/L de ciprofloxacina41.
Los ensayos realizados con ibuprofeno para evidenciar la capacidad de Chrysopogon zizanioides como agente de fitoremediación de este fármaco, arrojaron resultados favorables con un porcentaje de remoción máximo de 73.33% a las 192 h (Figura 2C). En otro estudio, se demostró que el ibuprofeno puede ser removido de un medio acuoso en su totalidad por la especie Phragmites australis después de 21 días de exposición a una concentración de 60 mg/L50. Bajo estos parámetros es posible que Chrysopogon zizanioides tenga la misma capacidad de remoción con respecto al ibuprofeno por lo que se sugieren ensayos a futuro que consideren tiempos prolongados de exposición de esta especie vegetal en medio acuoso con este fármaco.
En este estudio se logró un porcentaje máximo de remoción del 73.33% del diclofenaco a las 192 h (Figura 2D), los valores máximos obtenidos en este estudio resultan semejantes a otros reportes donde se usaron especies vegetales para determinar sus capacidades de absorción del diclofenaco, como es el caso de la especie Typha latifolia que fue el objeto de estudio de51, quienes demostraron que dicha especie es capaz de absorber un máximo del 80.0% del diclofenaco presente en una concentración de 1mg/L.
Por otra parte, el acetaminofén arrojó valores máximos de 38.49% a las 192 h (Figura 2E) a una concentración de 3mg/L, siendo este valor de remoción el menor registrado entre los cinco fármacos analizados en este trabajo de investigación. Varias pueden ser las razones de la baja remoción, incluyendo las características del fármaco y su compatibilidad con la estructura de la especie vegetal evaluada. En un estudio usando Brassica juncea, el porcentaje de remoción para el acetaminofén alcanzó el 60.0% en 165 h a una concentración de 1 mM que corresponde aproximadamente a 150mg/L52 52.
Asimismo, se ha reportado en varios informes que Chrysopogon zizanioides tiene la capacidad de remover fenol, tetraciclina y 2,4,6-trinitrotolueno (TNT) del sustrato en el que crece47. Chrysopogon zizanioides puede considerarse como uno de los mejores fitorremediadores de la acrilamida por ser una planta perenne con gran biomasa y un sistema radicular largo, denso y extendido, por lo que esta planta es capaz de absorber acrilamida en el suelo durante un largo período de tiempo40.
En comparación con otras plantas, Chrysopogon zizanioides es más eficiente en la absorción de ciertos metales pesados y productos químicos debido a la capacidad de su sistema de raíces para alcanzar mayores profundidades y volumen. Asimismo, se descubrió que esta planta es altamente tolerante en condiciones extremadamente adversas, por lo tanto, se puede utilizar para la rehabilitación de relaves mineros, vertederos de basura y vertederos de desechos industriales que a menudo son extremadamente ácidos o alcalinos, ricos en metales pesados y bajos en nutrientes para las plantas 43. Adicionalmente, sostienen que las plantas pueden limpiar muchos tipos de contaminantes como metales, pesticidas, aceites y explosivos17
Es importante señalar que Chrysopogon zizanioides se mantuvo fresca y saludable durante las 192 h que duró el experimento, en todas las soluciones preparadas a las cuatro concentraciones consideradas en este estudio, lo que demuestra que es una especie resistente y apropiada para la fitorremediación de estos contaminantes emergentes, esto es consistente con otros reportes que indican esta especie fue bastante resistente, inclusive a la radiación en comparación con otras plantas53. En otro estudio se demostró un crecimiento normal y aparentemente saludable de Chrysopogon zizanioides por un periodo de 12 meses en un suelo contaminado por una mina de hierro54.
Los resultados obtenidos en este estudio reflejan la eficiencia del vetiver (Chrysopogon zizanioides) en la remoción de los cinco fármacos del estudio, lo que demuestra que la técnica de fitorremediación funciona eficientemente bajo condiciones controlada (invernadero) y pudiera ser prometedora a mayor escala, lo cual fue probado en 1995 en Queensland, Australia, donde este pasto, fue reconocido por primera vez por tener características «súper absorbentes» adecuadas para la eliminación de lixiviados y efluentes generados en vertederos y plantas de tratamiento de aguas residuales, lo mismo fue corroborado por científicos chinos en 1997 y desde entonces el denominado Sistema Vetiver se ha utilizado con éxito para estos fines en Australia, China y Tailandia44,47. Vetiver atrajo la atención mundial como un medio natural para diversas aplicaciones ambientales, incluyendo la desintoxicación de suelos y agua contaminados46.
CONCLUSIONES
En este estudio la especie vetiver (Chrysopogon zizanioides) removió porcentajes considerables de los cinco fármacos estudiados sulfametoxazol, ciprofloxacina, acetaminofén, ibuprofeno y diclofenaco en medio acuoso.
Se ha podido determinar que (Chrysopogon zizanioides) removió de forma eficiente en todas las soluciones a las cuatro concentraciones preestablecidas de ciprofloxacina e ibuprofeno, alcanzando una remoción máxima de 98.00% y 73.00%, respectivamente a una concentración de 3mg/L.
Con sulfametoxazol en las primeras 48 horas se alcanzó una remoción de aproximadamente 50.00% y de más del 70.00% al finalizar el experimento, en concentraciones bajas de alrededor de 3mg/L.
Los resultados para la remoción del diclofenaco en las condiciones establecidas fueron muy interesantes, pues se alcanzó una remoción de 73.00% aproximadamente a altas concentraciones (12mg/L) en los tiempos finales del experimento.
En el caso del acetaminofén, la remoción por parte del vetiver se presentó relativamente baja en todas las concentraciones establecidas en el estudio. Sin embargo, no deja de ser importante la remoción producida de 38.49% a concentraciones de 3mg/L.
La metodología superficie de respuesta permitió establecer los máximos porcentajes de remoción de los cinco fármacos en las condiciones establecidas para el estudio. Asimismo, ha permitido observar la proyección de la investigación en dirección a obtener los tiempos y concentraciones óptimos, de tal forma que en próximos estudios se podría aumentar o reducir las concentraciones y variar el tiempo.
En este trabajo de investigación se demostró la alta capacidad removedora de Chrysopogon zizanioides de los cinco fármacos estudiados en medio acuoso en condiciones controladas, vislumbrando un gran potencial en el ámbito de la biotecnología ambiental para el tratamiento terciario de aguas residuales con miras a eliminar los productos farmacéuticos en mención.
Agradecimientos
Al Centro de Investigaciones Biotecnológicas de la Escuela Superior Politécnica del Litoral por haber facilitado las instalaciones del invernadero y sus laboratorios para el desarrollo de los experimentos. Así mismo se le agradece el financiamiento proveniente de la Dirección de Investigación de la Universidad de Cuenca (DIUC) a través del proyecto DUIC_XIV_2016_037.
REFERENCIAS
1. Farré, M. la, Pérez, S., Kantiani, L. & Barceló, D. Fate and toxicity of emerging pollutants, their metabolites and transformation products in the aquatic environment. TrAC – Trends Anal. Chem. 27, 991–1007 (2008).
2. Hossain, A. et al. Occurrence and ecological risk of pharmaceuticals in river surface water of Bangladesh. Environ. Res. 165, 258–266 (2018).
3. Ebele, A. J., Abou-Elwafa Abdallah, M. & Harrad, S. Pharmaceuticals and personal care products (PPCPs) in the freshwater aquatic environment. Emerg. Contam. 3, 1–16 (2017).
4. Peña-Guzmán, C. et al. Emerging pollutants in the urban water cycle in Latin America: A review of the current literature. J. Environ. Manage. 237, 408–423 (2019).
5. Gogoi, A. et al. Occurrence and fate of emerging contaminants in water environment: A review. Groundw. Sustain. Dev. 6, 169–180 (2018).
6. Fang, W., Peng, Y., Muir, D., Lin, J. & Zhang, X. A critical review of synthetic chemicals in surface waters of the US, the EU and China. Environ. Int. 131, 104994 (2019).
7. Paíga, P. et al. Presence of pharmaceuticals in the Lis river (Portugal): Sources, fate and seasonal variation. Sci. Total Environ. 573, 164–177 (2016).
8. Kibuye, F. A. et al. Fate of pharmaceuticals in a spray-irrigation system: From wastewater to groundwater. Sci. Total Environ. 654, 197–208 (2019).
9. Fekadu, S., Alemayehu, E., Dewil, R. & Van der Bruggen, B. Pharmaceuticals in freshwater aquatic environments: A comparison of the African and European challenge. Sci. Total Environ. 654, 324–337 (2019).
10. Gamarra, J. S., Godoi, A. F. L., de Vasconcelos, E. C., de Souza, K. M. T. & Ribas de Oliveira, C. M. Environmental Risk Assessment (ERA) of diclofenac and ibuprofen: A public health perspective. Chemosphere 120, 462–469 (2015).
11. Balakrishna, K., Rath, A., Praveenkumarreddy, Y., Guruge, K. S. & Subedi, B. A review of the occurrence of pharmaceuticals and personal care products in Indian water bodies. Ecotoxicol. Environ. Saf. 137, 113–120 (2017).
12. Alidina, M. et al. The occurrence of emerging trace organic chemicals in wastewater effluents in Saudi Arabia. Sci. Total Environ. 478, 152–162 (2014).
13. Batt, A. L., Furlong, E. T., Mash, H. E., Glassmeyer, S. T. & Kolpin, D. W. The importance of quality control in validating concentrations of contaminants of emerging concern in source and treated drinking water samples. Sci. Total Environ. 579, 1618–1628 (2017).
14. Zhang, S., Gitungo, S., Axe, L., Dyksen, J. E. & Raczko, R. F. A pilot plant study using conventional and advanced water treatment processes: Evaluating removal efficiency of indicator compounds representative of pharmaceuticals and personal care products. Water Res. 105, 85–96 (2016).
15. Rigobello, E. S., Dantas, A. D. B., Di Bernardo, L. & Vieira, E. M. Removal of diclofenac by conventional drinking water treatment processes and granular activated carbon filtration. Chemosphere 92, 184–191 (2013).
16. Afonso-Olivares, C., Sosa-Ferrera, Z. & Santana-Rodríguez, J. J. Occurrence and environmental impact of pharmaceutical residues from conventional and natural wastewater treatment plants in Gran Canaria (Spain). Sci. Total Environ. 599–600, (2017).
17. Shikha, S. & Gauba, P. Phytoremediation of Industrial and Pharmaceutical Pollutants. Recent Adv. Biol. Med. 02, 113 (2016).
18. Szekeres, E. et al. Investigating antibiotics, antibiotic resistance genes, and microbial contaminants in groundwater in relation to the proximity of urban areas. Environ. Pollut. 236, 734–744 (2018).
19. Miller, E. L., Nason, S. L., Karthikeyan, K. G. & Pedersen, J. A. Root Uptake of Pharmaceuticals and Personal Care Product Ingredients. Environmental Science and Technology 50, (2016).
20. Küster, A. & Adler, N. Pharmaceuticals in the environment: Scientific evidence of risks and its regulation. Philos. Trans. R. Soc. B Biol. Sci. 369, (2014).
21. Liu, J. L. & Wong, M. H. Pharmaceuticals and personal care products (PPCPs): A review on environmental contamination in China. Environ. Int. 59, 208–224 (2013).
22. Kermia, A. E. B., Fouial-Djebbar, D. & Trari, M. Occurrence, fate and removal efficiencies of pharmaceuticals in wastewater treatment plants (WWTPs) discharging in the coastal environment of Algiers. Comptes Rendus Chim. 19, 963–970 (2016).
23. Sharma, B. M. et al. Health and ecological risk assessment of emerging contaminants (pharmaceuticals, personal care products, and artificial sweeteners) in surface and groundwater (drinking water) in the Ganges River Basin, India. Sci. Total Environ. 646, 1459–1467 (2019).
24. Voloshenko-Rossin, A. et al. Emerging pollutants in the Esmeraldas watershed in Ecuador: Discharge and attenuation of emerging organic pollutants along the San Pedro-Guayllabamba-Esmeraldas rivers. Environ. Sci. Process. Impacts 17, 41–53 (2015).
25. Brausch, J. M., Connors, K. A., Brooks, B. W. & Rand, G. M. Reviews of Environmental Contamination and Toxicology Volume 218. 218, (2012).
26. Lai, W. W. P., Lin, Y. C., Tung, H. H., Lo, S. L. & Lin, A. Y. C. Occurrence of pharmaceuticals and perfluorinated compounds and evaluation of the availability of reclaimed water in Kinmen. Emerg. Contam. 2, 135–144 (2016).
27. Sui, Q. et al. Occurrence, sources and fate of pharmaceuticals and personal care products in the groundwater: A review. Emerg. Contam. 1, 14–24 (2015).
28. Jiang, Y. et al. Occurrence, seasonal variation and risk assessment of antibiotics in Qingcaosha reservoir. Water (Switzerland) 10, (2018).
29. Li, W., Shi, Y., Gao, L., Liu, J. & Cai, Y. Occurrence of antibiotics in water, sediments, aquatic plants, and animals from Baiyangdian Lake in North China. Chemosphere 89, 1307–1315 (2012).
30. Shraim, A. et al. Analysis of some pharmaceuticals in municipal wastewater of Almadinah Almunawarah. Arab. J. Chem. 10, S719–S729 (2017).
31. Guerra, P., Kim, M., Shah, A., Alaee, M. & Smyth, S. A. Occurrence and fate of antibiotic, analgesic/anti-inflammatory, and antifungal compounds in five wastewater treatment processes. Sci. Total Environ. 473–474, 235–243 (2014).
32. Semerjian, L., Shanableh, A., Semreen, M. H. & Samarai, M. Human health risk assessment of pharmaceuticals in treated wastewater reused for non-potable applications in Sharjah, United Arab Emirates. Environ. Int. 121, 325–331 (2018).
33. Kwarciak-Kozłowska, A. Removal of pharmaceuticals and personal care products by ozonation, advance oxidation processes, and membrane separation. Pharmaceuticals and Personal Care Products: Waste Management and Treatment Technology (Elsevier Inc., 2019). doi:10.1016/b978-0-12-816189-0.00007-x
34. Rivera-Jaimes, J. A. et al. Study of pharmaceuticals in surface and wastewater from Cuernavaca, Morelos, Mexico: Occurrence and environmental risk assessment. Sci. Total Environ. 613–614, 1263–1274 (2018).
35. Lin, H. et al. Mass loading and emission of thirty-seven pharmaceuticals in a typical municipal wastewater treatment plant in Hunan Province, Southern China. Ecotoxicol. Environ. Saf. 147, 530–536 (2018).
36. Kalia, V. C. Pharmaceutical and personal care product contamination: a global scenario. Pharmaceuticals and Personal Care Products: Waste Management and Treatment Technology (Elsevier Inc., 2019). doi:10.1016/b978-0-12-816189-0.00002-0
37. Rasheed, T., Bilal, M., Nabeel, F., Adeel, M. & Iqbal, H. M. N. Environmentally-related contaminants of high concern: Potential sources and analytical modalities for detection, quantification, and treatment. Environ. Int. 122, 52–66 (2019).
38. Yang, Y., Ok, Y. S., Kim, K. H., Kwon, E. E. & Tsang, Y. F. Occurrences and removal of pharmaceuticals and personal care products (PPCPs) in drinking water and water/sewage treatment plants: A review. Science of the Total Environment 596–597, (2017).
39. Bai, X. et al. Occurrence, distribution, and seasonality of emerging contaminants in urban watersheds. Chemosphere 200, (2018).
40. Paz-Alberto, A. M. & Sigua, G. C. Phytoremediation: A Green Technology to Remove Environmental Pollutants. Am. J. Clim. Chang. 02, 71–86 (2013).
41. Panja, S., Sarkar, D., Li, K. & Datta, R. Uptake and transformation of ciprofloxacin by vetiver grass (Chrysopogon zizanioides). Int. Biodeterior. Biodegrad. 142, 200–210 (2019).
42. Mishra, S. & Maiti, A. The efficiency of Eichhornia crassipes in the removal of organic and inorganic pollutants from wastewater: a review. Environ. Sci. Pollut. Res. 24, 7921–7937 (2017).
43. Suelee, A. L., Hasan, S. N. M. S., Kusin, F. M., Yusuff, F. M. & Ibrahim, Z. Z. Phytoremediation Potential of Vetiver Grass (Vetiveria zizanioides) for Treatment of Metal-Contaminated Water. Water. Air. Soil Pollut. 228, (2017).
44. Maharjan, A. & Pradhanang, S. Potential of Vetiver Grass for Wastewater Treatment. Environ. Ecol. Res. 5, 489–494 (2017).
45. Kiiskila, J. D., Sarkar, D., Panja, S., Sahi, S. V. & Datta, R. Remediation of acid mine drainage-impacted water by vetiver grass (Chrysopogon zizanioides): A multiscale long-term study. Ecol. Eng. 129, 97–108 (2019).
46. Kiiskila, J. D., Li, K., Sarkar, D. & Datta, R. Metabolic response of vetiver grass (Chrysopogon zizanioides) to acid mine drainage. Chemosphere 240, 124961 (2020).
47. Panja, S., Sarkar, D. & Datta, R. Vetiver grass (Chrysopogon zizanioides) is capable of removing insensitive high explosives from munition industry wastewater. Chemosphere 209, 920–927 (2018).
48. Datta, R. et al. Phytoremediation Potential of Vetiver Grass [Chrysopogon zizanioides (L.)] for Tetracycline. Int. J. Phytoremediation 15, 343–351 (2013).
49. Chen, H. R. et al. Assessment of veterinary drugs in plants using pharmacokinetic approaches: The absorption, distribution and elimination of tetracycline and sulfamethoxazole in ephemeral vegetables. PLoS One 12, 1–16 (2017).
50. He, Y. et al. Metabolism of Ibuprofen by Phragmites australis: Uptake and Phytodegradation. Environ. Sci. Technol. 51, 4576–4584 (2017).
51. Bartha, B., Huber, C. & Schröder, P. Uptake and metabolism of diclofenac in Typha latifolia – How plants cope with human pharmaceutical pollution. Plant Sci. 227, 12–20 (2014).
52. Bartha, B., Huber, C., Harpaintner, R. & Schröder, P. Effects of acetaminophen in Brassica juncea L. Czern.: Investigation of uptake, translocation, detoxification, and the induced defense pathways. Environ. Sci. Pollut. Res. 17, 1553–1562 (2010).
53. Roongtanakiat, N. & Akharawutchayanon, T. Evaluation of vetiver grass for radiocesium absorption ability. Agric. Nat. Resour. (2017). doi:10.1016/j.anres.2017.01.002
54. Banerjee, R., Goswami, P., Lavania, S., Mukherjee, A. & Lavania, U. C. Vetiver grass is a potential candidate for phytoremediation of iron ore mine spoil dumps. Ecol. Eng. 132, 120–136 (2019).
Recibido: 5 octubre 2020
Aceptado: 15 noviembre 2020
Checa-Artos Miriam1, Sosa del Castillo Daynet1, Vanegas María Eulalia3, Ruiz-Barzola Omar1,2, Barcos-Arias Milton1*
1Escuela Superior Politécnica del Litoral, ESPOL, Facultad de Ciencias de la Vida, FCV, Centro de Investigaciones Biotecnológicas del Ecuador, CIBE, Campus Gustavo Galindo Km 30.5 Vía Perimetral, ESPOL, Apartado Postal: 09-01-5863, Guayaquil, Ecuador.
2Departamento de Estadística, Universidad de Salamanca, USal, Salamanca-España.
3Centro de Estudios Ambientales, Departamento de Química Aplicada y Sistemas de Producción, Facultad de Ciencias Químicas, Universidad de Cuenca, Av 12 de Abril y Agustín Cueva, Cuenca, Ecuador.
*Autor para correspondencia; mbarcos@espol.edu.ec.
ORCID
Miriam Checa Artos https://orcid.org/0000-0002-9606-7896
Daynet Sosa del Castillo https://orcid.org/0000-0001-5403-9072
María Eulalia Vanegas https://orcid.org/0000-0003-1976-8346
Omar Ruiz Barzola https://orcid.org/0000-0001-8206-1744
Milton Barcos Arias https://orcid.org/0000-0003-0863-6778


















