Vol 6 No 1 2021 – 3
INVESTIGATION / RESEARCH
Optimización en la aclimatación de plántulas micropropagadas de banano (Musa sp.) utilizando tres insumos orgánicos.
Optimization in the acclimatization of banana micropropagated seedlings (Musa sp.) using three organic inputs.
Andy Fabricio Mora-González1,2; Jaime Alberto Naranjo-Morán1; Alexander Albiño-Quitiaquez1; José Alcides Flores-Cedeño1,2; Rodrigo Oviedo-Anchundia1; Luis Galarza-Romero1; Marisol Vera-Oyague2; Vicente Painii-Montero2; Milton Senen Barcos-Arias1*
Available from: http://dx.doi.org/10.21931/RB/2021.06.01.3
RESUMEN
El éxito de la micropropagación de plantas in vitro depende en parte de la fase de aclimatación, esta etapa presenta problemas de supervivencia y conlleva extensas semanas de adaptación. En este sentido, la utilización de microorganismos eficientes nativos son una alternativa biotecnológica para adaptar plantas in vitro. El presente trabajo tiene como objetivo evaluar el efecto de la aplicación de Trichoderma ghanense, micorrizas arbusculares y un biofertilizante líquido en plantas meristemáticas de banano variedad William en las fases de aclimatación y vivero. Para los ensayos en las fases de aclimatación y vivero se realizaron 20 tratamientos y se utilizó un diseño factorial 2(k) con una duración de seis semanas en ambas fases. Los resultados demuestran que en la fase de aclimatación el mejor tratamiento fue el B10 con incrementos del 29,6 % de altura y 19,9 % de diámetro respecto al control; mientras que, para el área foliar fue el B19 con 84,7 % de incremento en comparación al control. En fase de vivero el mejor tratamiento fue el B19 presentando incrementos del 14,5 % altura, 19,3 % diámetro del pseudotallo, 13,4 % área foliar, 91,8 % longitud radicular, 39,98 % peso húmedo y 90,5 % peso seco en comparación al control. Ambas fases alcanzaron porcentaje de micorrización mayores al 45 %. Los porcentajes de supervivencia fueron del 100 % en fase de aclimatación. Por lo expuesto, se concluye que los insumos orgánicos constituyen una alternativa para el manejo y adaptación de plantas producidas in vitro.
Palabras Clave: Adaptación, bioproductos, micorrización, banano
ABSTRACT
The successful micropropagation process of banana in vitro plants differs on the acclimatization stage, so there are survival problems at this stage, and it involves several weeks of adaptation. Therefore, the use of efficient microorganisms is a biotechnological alternative for the adaptation of in vitro plants. The present work aims to evaluate the effect of Trichoderma ghanense, arbuscular mycorrhizae, and a liquid biofertilizer in meristematic plants of banana variety William in the acclimatization and vivarium phases. Factorial design 2(k) with 20 treatments were used under greenhouse conditions for six weeks in two phases. The best treatment on the acclimatization phase was B10, increasing the height by 29.6 % and the diameter by 19.9 %, while the leaf area the best treatment was B19 with an 84.7 % increase. Identically, into the nursery phase, the best treatment was B19, with increases of 14.5 % height, 19.3 % diameter of pseudostem, 13.4 % foliar area, 91.8 % root length, 39.98 % wet weight, and 90.5 % dry weight. Finally, in both phases, the mycorrhization percentage was more significant than 45 %. The survival percentages were 100 % during the acclimatization phase. Therefore, it is concluded that bioproducts constitute an alternative for the management and adaptation of plants produced by in vitro methodology.
Keywords: Adaptation, bioproducts, mycorrhization, banana
INTRODUCCIÓN
La multiplicación meristemática de banano in vitro resuelve problemas fitosanitarios y constituye una herramienta en el mejoramiento genético para la obtención de plantas elites con desarrollo vigoroso,1,2 esta técnica comprende las etapas de establecimiento, multiplicación, enraizamiento, aclimatación y vivero1. La eficiencia y calidad del proceso de las plantas meristemáticas dependen en parte de la fase de aclimatación y vivero; dado que, las condiciones ambientales son diferentes a las condiciones in vitro3, los explantes enraizados son sensibles a cambios agrometeorológicos provocando que las mismas no sobrevivan e incluso tarden extensas semanas para su adaptación4. Por tal motivo, en la fase de aclimatación es necesario temperaturas promedias de 25 ± 2 °C con 70 a 90 % de humedad relativa y baja luminosidad5.
En las fases de aclimatización y vivero de las plantas de banano, estas dejan de usar medios ricos de sales y hormonas, por un sustrato que puede estar conformado por compost, arena, cascarilla de arroz, humus de lombriz o turba, con el fin de adaptar las plantas a condiciones ambientales6, sin embargo, el sustrato puede complementarse con insumos orgánicos que ayudan a mejorar la aclimatación de las plantas7,8. Se ha demostrado que aplicar biol, hongos micorrízicos arbusculares (HMA) y cepas de Trichoderma spp., como insumos en el sustrato, ayudan al desarrollo radicular y aéreo de las plantas9.
La aplicación de HMA en plantas meristemáticas de banano (Musa paradisiaca) en fase de aclimatación ha permitido registrar mejoras cuantificables en crecimiento y grosor del pseudotallo de las plantas in vitro, incrementando el contenido de nitrógeno y fósforo en las hojas. Adicionalmente, la simbiosis entre raíces de las plantas y HMA producen un intercambio bidireccional de nutrientes10 y mejora la fertilidad del suelo creando una nutrición balanceada11. Así mismo, inocular microorganismos del género Trichoderma y HMA en plantas obtenidas in vitro ha permitido que las plántulas se adapten mejor a las condiciones de invernadero12.
Las cepas de hongos del género Trichoderma son consideradas como biocontroladoras de enfermedades, que ayudan a mejorar la producción y rentabilidad de diferentes cultivos; por su parte, las diferentes especies de Trichoderma poseen mecanismos de acción; tales como, micoparasitismo, antibiosis, competición por los nutrientes, biofertilización y producción de compuestos volátiles13. Las Trichodermas a través del mecanismo de biofertilización solubiliza nutrientes del suelo y los proporciona a las plantas, esto lo logra a través de su rápido crecimiento hifal que penetra la epidermis de la raíz14.
Estudios por Cromatografía Líquida de Alta Resolución (por sus siglas en inglés HPLC) de cepas de Trichoderma ghanense, Trichoderma harzianun y Trichoderma hamatum inoculadas en plantas de Cucumis melo, demostró la producción de fitohormonas que influyen en la defensa de las plantas como ácido salicílico (AS) y ácido jasmónico (AJ) en las raíces y brotes15. Por otra parte, el biol conocido como un abono líquido orgánico obtenido por descomposición anaeróbica de microorganismos, es considera como un biofertilizante para el fortalecimiento y nutrición de las plantas, que a su vez ayuda a reducir los problemas de estrés abiótico y permite la recuperación y reactivación de la vida del suelo16,17. Con estos antecedentes, este trabajo tiene como objetivo evaluar el efecto de la aplicación de Trichoderma ghanense, micorrizas arbusculares y un biofertilizante líquido (biol) en plantas meristemáticas de banano variedad Williams en las fases de aclimatación y vivero, con el fin, de determinar cuál es la mejor combinación.
MATERIALES Y MÉTODOS
Material vegetal y bioinsumos
Las plantas meristemáticas de banano variedad Williams utilizadas en este estudio disponían de una altura inicial de 2,5 cm provenientes del laboratorio de cultivo de tejidos del Centro de Investigaciones Biotecnológicas del Ecuador de la Escuela Superior Politécnica del Litoral (CIBE-ESPOL).
La cepa Trichoderma ghanense, el biol y el consorcio de HMA (Acaulospora sp., Ambispora sp., Diversispora sp., Entrophospora sp., Funneliformis sp. y Glomus sp.) pertenecen al banco de microorganismos del CIBE.
Condiciones del experimento
El experimento constó de una primera fase de aclimatación (FA) y una segunda fase de vivero (FV), en ambas fases se empleó un sustrato que contenía arena y turba en proporción 2:1, las características fisicoquímicas del sustrato son: pH 6,8 (suelo: agua 1:2,5), 1,5 % de materia orgánica (Walkey Black), y en (µg/mL) 13.0 de N, 21.0 de P, 0.5 de B (colorimetría), 56.0 de K, 1993.0 de Ca, 245.0 de Mg, 1.7 de Zn, 14.0 de Fe (absorción atómica), 41.0 de S (turbidimetría).
El sustrato se colocó en fundas de polietileno de color negro que contenían un volumen de 250 g para la FA; mientras que, en la FV las fundas contenían un volumen de 1750 g. Las plantas de banano crecieron a una temperatura de 28 ± 2 ºC y 75 % de humedad relativa.
El riego en la FA se aplicó 5 mL/planta, tres días a la semana; mientras que, en la FV fue 50 mL/planta, tres días a la semana18. La aplicación de los insumos orgánicos se realizó en las dosis recomendadas según las descripciones de los tratamientos planteados en el diseño experimental, la inoculación del consorcio de los HMA fue realizado una sola vez al momento del trasplante, aplicando entre 50 y 100 g de inoculo, con una concentración de 20 esporas/g de sustrato19. Con respecto a la inoculación de T. ghanense se realizó agregando una suspensión de esporas (10 mL/planta) a una concentración de 1×104 y 1×108 según el tratamiento, esto se aplicó al inicio en cada una de las fases y a los 15 días después del trasplante 20.
El biol fue aplicado al sustrato desde el inicio hasta la finalización de los experimentos en ambas fases con dosis de 5 mL/planta con intervalos de 15 días17. La fertilización convencional se realizó dos veces por semana aplicando un volumen de 5 mL/planta en la FA y 10 mL/planta en la FV según los tratamientos. La fertilización convencional contenía en (g/L): 0,9 de NH4NO3, 1,04 de NH4H2PO4 y 0,85 de KCl.
Se empleó un diseño experimental factorial 2(4) para la FA y FV considerando como factores en estudios: micorrizas arbusculares, Trichoderma ghanense, biol y la fertilización convencional, como se describen en la tabla 1.

Tabla 1. Descripción de las combinaciones del diseño experimental 2(4).
Parámetros agronómicos y fisiológicos
En la FA se evaluaron parámetros de altura, diámetro del pseudotallo, área foliar y porcentaje de micorrización; mientras que, en la FV además de los parámetros antes mencionados se evaluaron contenido de clorofila, contenido de N-P-K en hojas, longitud radicular, peso seco, húmedo y reaislamiento de T. ghanense del sustrato al finalizar el experimento.
La altura se realizó con una regla milimetrada midiendo desde la base del pseudotallo hasta donde se bifurcan las dos últimas hojas. El diámetro del pseudotallo se midió en la base, utilizando un calibrador o pie de rey, marca electronic digital calipera. Para el área foliar se utilizó un escáner marca Edson L395, se cortaron y escanearon las tres últimas hojas más joven (no incluye la hoja cigarro), en formato imagen JPG para a través del software de procesamiento y análisis de imágenes ImageJ®, determinar el área foliar por cada tratamiento en estudio21.
Para cuantificar el contenido de clorofila, se realizaron lecturas a la sexta semana en la tercera hoja más joven de las plantas de banano, utilizando un medidor electrónico marca Minolta SPAD 502, que determina a la clorofila en unidades SPAD.
Para determinar el peso humedo y seco de las plantas de banano se pesaron en una balanza analítica (marca entris, modelo ENTRIS224i-1S de calibración interna), el peso seco se obtuvo después de secar las plantas en una estufa a 80 ºC hasta obtener el peso constante22.
Para cuantificar el contenido de N-P-K, se cortó la tercera hoja de los diferentes tratamientos. Las muestras fueron enviadas al laboratorio del INIAP Litoral del Sur “Dr. Enrique Ampuero Pareja”23, donde las muestras fueron pulverizadas mediante un molino eléctrico, luego fueron ingresadas a un digestor de microondas a temperatura de 200 ˚C por 1 h (Milestone, VAC-1000 ACID SCRUBBER MODULE), transcurrido este tiempo el digerido se analizó en un espectrofotómetro de absorción atómica (Perkin Elmer, Aanalyst 400).
Porcentaje de micorrización
Se empleó el procedimiento de tinción de raíces propuesto por Phillips y Hamman24. Se tomaron raíces de las plantas de banano y se lavaron con agua, fueron sumergidas en KOH al 10 % y autoclavadas por 10 min a 121 ºC (15 lb de presión). Se retiró el KOH para remplazarlo por HCl al 1 % dejando en reposo por 3 min, posteriormente se retiró el HCl y se agregó azul de tripano al 0,05 % en lactoglicerol y se autoclavó según las condiciones antes mencionadas. Las raíces fueron colocadas en portaobjetos para determinar el porcentaje de micorrización (% MIC) a través de la fórmula propuesta por McGonigle et al25.

Reaislamiento de Trichoderma ghanense
Se tomó 1 g del sustrato de los tratamientos que fueron inoculados con T. ghanense y se depositó en un tubo falcón de 14 mL que contenía 10 mL de agua destilada esterilizada. A partir de esta solución se realizaron diluciones seriadas hasta 10-3, luego se tomó 100 μL para ser sembrado en una caja petri con medio PDA e incubada a 30 ± 1 ºC por 96 horas26. Al crecer el hongo se realizó una resiembra en medio PDA; no obstante, para comprobar la presencia del T. ghanense se empleó la técnica de montaje con porta y cubre objeto adicionando azul de metileno al 1 % para la tinción del hongo French & Hebert27. Las estructuras morfológicas fueron comparadas con los reportes de Barrera28.
Análisis estadístico
Los datos se analizaron con estadística descriptiva, análisis de varianza (ANOVA) y comparación de contraste de medias con la prueba de Tukey (p≤0.05), previo de considerar la normalidad de los datos mediante la prueba de Shapiro-Wilk (α=0.05) mediante el uso del Software estadístico InfoStat versión estudiantil 2017.
RESULTADOS Y DISCUSIÓN
Adaptación de las plántulas de banano
Los tratamientos que fueron inoculados con T. ghanense, consorcio de micorrizas y biol presentaron un 100 % de supervivencia a la sexta semana en la fase de aclimatación en comparación al control que presentó un 84 % (tabla 2). Aplicando estos bioinsumos se mejoró el porcentaje de supervivencia de las plantas in vitro6, lo cual puede deberse a que las micorrizas; estimulan en las plantas la síntesis de proteínas implicadas en la tolerancia al estrés biótico y abiótico29, es decir, las raíces micorrizadas mantienen la integridad celular y limitan la necesidad de expansión de las células de la raíz, mejorando la absorción hídrica del suelo y aumentando el contenido de agua en la biomasa aérea, permitiendo optimizar el desarrollo de la planta30.
Ortas et al.9 aplicando de manera independiente especies de Glomus caledonium y Glomus macrocarpum alcanzaron 40,0 y 66,7 % de supervivencia en la fase de aclimatación en plantas de banano variedad Dwarf. Pérez et al.31 aclimatando plantas in vitro de Rubus glaucus utilizaron Glomus sp., Pseudomonas migulae y Bacillus amyloliquefaciens, lograron una mejor adaptación, desarrollo y vigor de las plántulas con una supervivencia del 80 %. Por otro lado, T. ghanense induce a las plantas a producir AS y AJ que influyen en la defensa contra el estrés abiótico, llegando a mejorar la adaptación en ambientes adversos15,32.

Tabla 2. Resultados de los parámetros agronómicos evaluados a la sexta semana de la fase de aclimatación
Variables agronómicas de la fase de aclimatación (FA)
A la sexta semana los tratamientos B10 y B8 para la altura y diámetro del pseudotallo presentaron los mejores valores con diferencias estadísticas significativas en comparación al control (tabla 2), los dos tratamientos son superiores en altura y similares en diámetro a los reportados por Montejo et al.33, quienes alcanzaron 8,0 cm de altura y 6,80 mm de diámetro a los 30 días en plantas de banano variedad FHIA-03 al crecer en un sustrato compuesto de bioinsumos sólidos a base de 50 % humus de lombriz y 50 % compost más la adición de un bioinsumo líquido de humus de lombriz fortificado con fitohormonas (auxinas, giberelinas), por otra parte, Acosta y Galindo34 observaron que sumergir las raíces en brasinoesteroide en una dosis de 0,01 mg/L en plantas in vitro de banano variedad FHIA-18, previo al trasplante en la fase de aclimatación obtuvieron 4,5 cm de altura y 6,6 mm de diámetro a los 45 días, siendo estos valores inferiores en altura y similares en diámetro a lo reportado en los tratamientos B10 y B8.
La aplicación combinada de T. ghanense y el consorcio de micorrizas favorecieron el crecimiento en altura y diámetro del tallo de las plantas de banano en fase de aclimatación, lo que puede deberse a que estos microorganismos tienen la capacidad de producir diferentes compuestos químicos como el ácido indolacético (AIA) y ácido indolbutírico (AIB), además de la solubilización del fósforo presente en el sustrato29. Robinson y Galán3, mencionan que una planta aclimatada de banano debe presentar una altura promedio de 7 cm y 6 mm de diámetro del pseudotallo para pasar a fase de vivero.
En la variable área foliar, evaluada a la sexta semana en la fase de aclimatación no se encontró diferencia estadística significativa entre los tratamientos en comparación al control, al aplicar el test estadístico de Tukey (p<0,05), no obstante, los tratamientos que contenían los bioinsumos presentaron promedios mayores al control, siendo el mejor tratamiento B19 alcanzando 38,14 ± 2,1 cm2 en comparación al control que alcanzó 20,65 ± 4,1 cm2 (Figura 1A). El resultado obtenido en el B19 fue superior al reportado por Acosta y Galindo34, quienes obtuvieron un área foliar de 25,93 cm2 al aclimatar plantas in vitro de banano FHIA-18, aplicando brasinoesteroide al momento del trasplante; lo que demuestra que la inoculación de HMA en el tratamiento B19 mejoró el desarrollo foliar de las plantas. Folli-Pereira et al.29, afirman que las diferentes respuestas morfológicas manifestadas en plantas micorrizadas involucran un superior desarrollo, seguido de cambios fisiológicos y bioquímicos, resultando en el aumento de las estructuras aéreas de las plantas, en este contexto, Estrada-Luna y Davis35 mencionan que una rápida colonización de HMA en las raíces mejora la fisiología de las plantas, incluso ayudan a recuperarse rápido durante la aclimatación y a generar un mayor crecimiento durante la post-aclimatación.
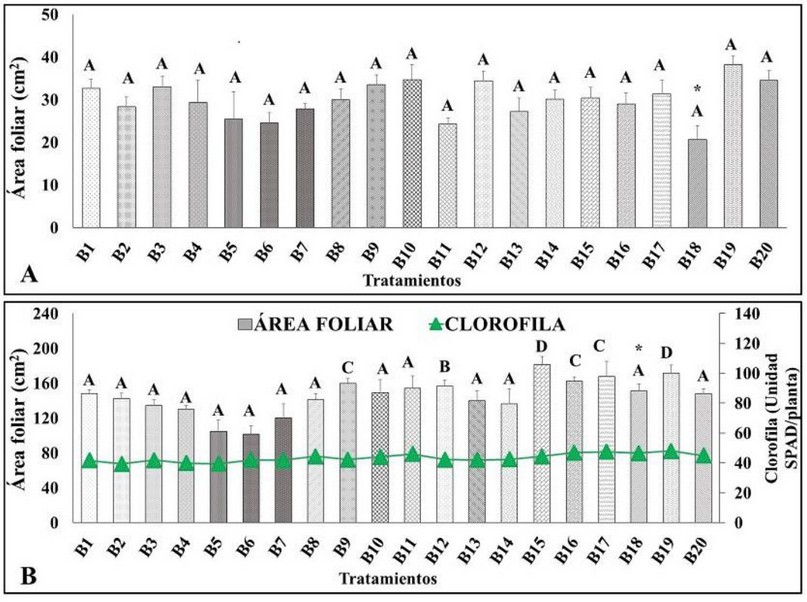
Figura 1. Comportamiento del área foliar. A: Área foliar evaluado a la sexta semana fase de aclimatación. B: Área foliar y contenido de clorofila evaluado a la sexta en fase de vivero. Letras distintas sobre las barras indican diferencias estadísticas significativas según test de Tukey (p<0,05); ± error experimental; * control.
Variables agronómicas de la fase de vivero (FV)
Los mejores resultados en altura y diámetro del pseudotallo en la FV se obtuvieron en el tratamiento B19 en comparación al control (tabla 3). El crecimiento en el B19 es favorecido por la presencia de los HMA ya que estos permiten la asimilación y solubilización de los minerales presentes en el sustrato36,37. Efectos similares han sido obtenidos por Koffi y Declerck6, quienes inoculando HMA en plantas in vitro de banano en condiciones controladas lograron a la quinta semana una altura de 15,02 cm y 17,8 mm de diámetro; mientras que, Barrera-Violeth et al38., inocularon Glomus sp., Acaulospora sp. y Scutellospora sp. en plantas de plátano, variedad Hartón en fase de vivero, obtuvieron crecimientos significativos de 50 cm de altura y 32,3 mm de diámetro a los 90 días.
El tratamiento B15 y B19 consiguieron un área foliar de 181,45 ± 9,3 cm2 y 171,50 ± 9,6 cm2 respectivamente, presentado estos dos tratamientos diferencia estadística significativa en comparación al control que alcanzó 151,24 ± 7,8 cm2 (Figura 1B), respecto al contenido de clorofila el mejor tratamiento fue el B17 obteniendo 47,4 ± 0,7 unidad SPAD en comparación al control que obtuvo 46,6 ± 0,7. Pérez et al31., aplicando una combinación de micorriza del género Glomus sp. y una Rhizobacteria (Pseudomonas migulae) en plantas in vitro de Rubus glaucus L., a los 80 días aumentó el área foliar a 73,87 cm2 respecto al control que consiguió 52,41 cm2, en este contexto, Estrada-Luna y Davis35, inocularon con HMA plantas micropropagadas de pimiento (Capsicum annuum) y observaron un mayor aumento del área foliar y contenido de clorofila a diferencia de las plantas que no contenían micorrizas.
El aumento del área foliar y contenido de clorofila de los tratamientos inoculados con HMA, T. ghanense y biol ejercieron efectos al aplicarlos directamente al sustrato, lugar donde crecen las raíces de las plantas39,es así, que la aplicación de un consorcio de HMA estimulan el desarrollo foliar, permitiendo una mayor actividad fotosintética o producción de fotoasimilados y contenido de clorofila40,41, mientras que, la aplicación del biofertilizante líquido (biol) aporta al sustrato con nitrógeno y fósforo asimilable para las plantas39.

Tabla 3. Variables de crecimientos evaluadas a la sexta semana de la fase de vivero
Análisis foliar, biomasa húmeda y seca
Los resultados del análisis foliar de las plantas meristemática de FV arrojaron que el tratamiento que presentó mayor contenido de potasio (K) en sus hojas fue el tratamiento B12 en comparación al control; los valores obtenidos en el B12 están en el rango óptimo según lo reportado por López y Espinoza42 ver (tabla 4).
El alto contenido de P y K presente en las plantas, indican que estos elementos fueron asimilados gracias a que sus raíces están inoculadas con HMA y la cepa T. ghanense; hongos que permiten la solubilización de los fosfatos del sustrato, micronutrientes y cationes minerales, como hierro, manganeso y magnesio, permitiendo que las plantas los absorban mejor43,41. En el trabajo reportado por Ortas et al.9, observaron que al inocular micorrizas del género Glomus caledonium se encontró en las hojas de plátano variedad Dwarf Cavendish una mayor absorción de 2,1 g/kg de fósforo; mientras que, al aplicar Glomus macrocarpum obtuvieron 1,3 g/kg, siendo superior al control 0,6 g/kg. Así mismo, Rui-Xia et al.32, observaron que al inocular T. harzianum surge un efecto directo en el desarrollo de la raíz, lo que repercute directamente en la absorción de los nutrientes.
La mayor cantidad de biomasa húmeda y seca en FV se presentó en los tratamientos B20 y B19, encontrando diferencias estadísticas significativas en comparación al control (tabla 4).
La respuesta observada en la producción de biomasa en el B20 podría deberse a la presencia de T. ghanense; mientras que, en el B19 a la inoculación de los HMA. Neyra et al.22. aplicando 5 mL de una suspensión 1×108 esporas/mL de Trichoderma viride estimuló el desarrollo de plántulas de Capsicum annum L. var. Longum generando una mayor cantidad de biomasa en condiciones de laboratorio, así mismo, Kamaruzzaman et al44., al aplicar T. harzianum evidenció una estimulación en el crecimiento y producción de biomasa en las plantas de Arachis hypogaea. Las cepas de microorganismos usadas en este trabajo aportaron a la asimilación de los nutrientes y estimularon el desarrollo de las plantas de banano41.

*Control fertilización convencional; a Rangos óptimos del análisis foliar según lo establecido por López y Espinoza (1995); nitrógeno (N), fósforo (P),
potasio (K); ± error experimental; letras distintas en la hilera indican diferencias significativas según test de Tukey (p<0,05).
Tabla 4. Resultados del análisis foliar de las plantas meristemática de banano y biomasa húmeda y seca evaluada a la sexta semana de la fase de vivero
Longitud radicular y porcentaje de micorrización
La mejor longitud radicular se encontró en el tratamiento B19, presentando diferencia estadística significativa en comparación al control (Figura 2A). El crecimiento radicular desarrollado en el tratamiento B19 podría deberse a la inoculación del consorcio de HMA nativos, donde se encontró un alto porcentaje de micorrización (Figura 2B).
En la FA los tratamientos inoculados con el consorcio de HMA presentaron valores entre 40 y 70 % de micorrización; mientras que, en la FV se obtuvo del 55 y 90 % siendo superiores a los de la FA; En ambas fases el tratamiento B19 fue el que presento mayor porcentaje de micorrización (Figura 2B) y (Figura 3 C-D). Koffi y Declerck6 inoculando HMA en plantas in vitro de banano bajo condiciones controladas, adquirieron porcentaje de micorrización de 40 y 64,7 % a la séptima semana, utilizando un sustrato compuesto de turba y arena en fase de aclimatación. Por su parte, Ortas et al.9, aplicaron de manera independiente especies de Glomus caledonium y Glomus macrocarpum, consiguiendo 50,8 y 68,8 % de micorrización en la fase de aclimatación en plantas de banano variedad Dwarf.
Los resultados obtenidos en la FV son superiores a los reportados por Navnita et al.45, quienes consiguieron porcentaje de micorrización entre 30,8 y 82,0 % a los 120 días utilizando interacciones de HMA como Glomus mosseae y Acaulospora laevis y una cepa de Trichoderma sp., en este contexto Barrera-Violeth et al.38, en plantas de plátano Hartón inoculando géneros de micorriza Glomus sp., Acaulospora sp., y Scutellospora sp., en fase de vivero obtuvieron porcentaje de micorrización de 91,1 %. Por lo tanto, se comprueba que trabajar con un consorcio de micorrizas garantiza una mayor infección de los HMA en plantas de banano.
Al finalizar el experimento en la fase de vivero, se comprobó la presencia de T. ghanense a través de la caracterización morfológica de Barrera28, en los tratamientos que fueron inoculados figura 3 A-B.

Figura 2. Longitud radicular y porcentaje de micorrización. A: Valores promedios de la longitud radicular de los tratamientos en fase de vivero; letras distintas sobre las barras indican diferencias estadísticas significativas según test de Tukey (p<0,05); ± error experimental; * control. B: Porcentaje de micorrización de las fases de aclimatación y vivero evaluada a la sexta semana después de la inoculación; * tratamientos sin la inoculación de HMA.

Figura 3. Microestructuras de la cepa Trichoderma ghanense reaisladas del sustrato al finalizar el ensayo y del consorcio de HMA, A y B) Conidios y fiálides tuberculadas o lageniforme de T. ghanense, C y D) Hifas y vesículas del consorcio de HMA observadas en lente de 40X.
CONCLUSIONES
La aplicación de bioinsumos mejoran los parámetros morfológicos, fisiológicas y de nutrición en las plantas meristemática de banano en la fase de aclimatación y vivero al promover la asimilación de los nutrientes presentes en el sustrato, lo que se traduce en un menor nivel de estrés al trasplante, periodos cortos de las fases de aclimatación y vivero, y una tasa de mortalidad de 0%. A través del análisis foliar se comprobó que los tratamientos inoculados con el consorcio de micorrizas, T. ghanense y el biol lograron alcanzar rangos óptimos de nutrición en nitrógeno, fósforo y potasio en la fase de vivero. Así las plantas de B19 (Fertilización convencional + Micorriza 100 g) a la sexta semana en la fase de vivero, alcanzaron los parámetros óptimos de altura y diámetro (tabla 3), para ser trasplantadas a campo, lo que reduce a la mitad los tiempos de entrega a los productores bananeros.
T. ghanense y el consorcio de los hongos formadores de micorrizas demostraron estimular el crecimiento de las plantas de banano en fase de aclimatación y vivero, esto se podría deber a la producción de fitasa, enzima que tiene la capacidad de liberar fósforo asimilable para las plantas, o mediante la producción de fitohormonas generada por ambos microorganismos.
Conflicto de interés
Los autores declaran que no tienen conflictos de intereses
REFERENCIAS
1. Silué, O., Kouassi, K., Koffi, K., Kouakou, K., Aké, S. Effect of adenine sulphate, casein hydrolysate and spermidine on in vitro shoot multiplication of two banana varieties (FHIA-21 and PITA-3). Afr J Biotechnol. 2017. 16(46), 2152-2159. doi: 10.5897/AJB2017.16247
2. Datta, S., Jankowicz-Cieslak, J., Nielen, S., Ingelbrecht, I., Till, B.J. Induction and recovery of copy number variation in banana through gamma irradiation and low‐coverage whole‐genome sequencing. Plant Biotechnol J. 2018. 16(9), 1-10. doi: 10.1111/pbi.12901
3. Robinson, J. C., Galán, V. Weaning (acclimatization) of in vitro produced banana plants. Fruits. 2009. 64(5), 325-332. doi: 10.1051/fruits:2009026
4. Jofre, A. E., Vázquez, M. N., Hernádez, A. R., Dávalos, P. A. Production and acclimatization of in vitro produced strawberry plants. In Acta Horticulturae. 2006. 727(5), 67-72. doi:10.17660/ActaHortic.2006.727.5
5. Gago, J., Martínez-Núñez, L., Landín, M., Flexas, J., Gallego, P. Modeling the effects of light and sucrose on in vitro propagated plants: A multiscale system analysis using artificial intelligence technology. Plos One. 2014. 9(1), 1-11. doi: 10.1371/journal.pone.0085989
6. Koffi, M. C, Declerck, S. In vitro mycorrhization of banana (Musa acuminata) plantlets improves their growth during acclimatization. In vitro Cell Dev Biol-Plant. 2015. 51(3), 265-273. doi: 10.1007/s11627-015-9666-0
7. Pinker, I., Vuksani, G., Dietz, R., Böhme, M. Effects of different substrates on acclimatization of Echinodorus in vitro plants in greenhouse conditions. Prop Orn Plants. 2007. 7 (4),195-198. Retrieved from https://www.researchgate.net/publication/261860725_Effects_of_different_substrates_on_acclimatization_of_Echinodorus_in_vitro_plants_in_greenhouse_conditions
8. Zhang, J., Wang, Y., Wang, P., Zhang, Q., Yan, C., Yu, F. Effect of different levels of nitrogen, phosphorus, and potassium on root activity and chlorophyll content in leaves of Brassica oleracea seedlings grown in vegetable nursery substrate. Hortic Environ Biotechnol. 2017. 58(1), 5-11. doi: 10.1007/s13580-017-0177-2
9. Ortas, I., Rafique, M., Akpinar, C., Aka, Y. Growth media and mycorrhizal species effect on acclimatization and nutrient uptake of banana plantlets. Sci Hortic. 2017. 217(15), 55-60. doi: 10.1016/j.scienta.2017.01.025
10. Smith, S., Read, D. Mycorrhizal symbiosis. Third edition. Great Britain. Editorial Book AID international. 2008. 11-13. Retrieved from https://www.elsevier.com/books/mycorrhizal-symbiosis/smith/978-0-12-370526-6
11. Johnson, N. C., Gehring, C., Jansa, J. Mycorrhizas: At the Interface of Biological, Soil, and Earth Sciences. In Mycorrhizal Mediation of Soil: Fertility, Structure, and Carbon Storage. Elsevier Inc. 2016. 1-6. doi: 10.1016/B978-0-12-804312-7.00001-2
12. Kavoo-Mwangi, A. M., Kahang, E. M., Ateka, E., Onguso, J., Jefwa, J. M. Integration of commercial microbiological products into soil fertility practices as a potential option for acclimatization and growth of TC banana in Kenya. OJSS. 2014. 4(8), 259-271. doi: 10.4236/ojss.2014.48028
13. Benítez, T., Rincón, A., Limón, M., Codón, A. Biocontrol mechanisms of Trichoderma strains. Int Microbiol. 2004. (4), 249-260. Retrieved from https://www.researchgate.net/publication/8065870_Biocontrol_mechanism_of_Trichoderma_strains
14. Druzhinina, I. S., Chenthamara, K., Zhang, J., Atanasova, L., Yang, D., Miao, Y., Rahimi, M. J., Grujic, M., Cai, F., Pourmehdi, S., Salim, K. A., Pretzer, C., Kopchinskiy, A. G., Henrissat, B., Kuo, A., Hundley, H., Wang, M., Aerts, A., Salamov, A., Lipzen, A., LaButti, K., Barry, K., Grigoriev, IV., Shen, Q., Kubicek, C. P. Massive lateral transfer of genes encoding plant cell wall-degrading enzymes to the mycoparasitic fungus Trichoderma from its plant-associated hosts. PLoS Genet. 2018. 14(4), e1007322. doi: 10.1371/journal.pgen.1007322.
15. Martínez-Medina, A., Alguacil., M. D., Pascual, J. A., Van, S. C. Phytohormone profiles induced by Trichoderma isolates correspond with their biocontrol and plant growth-promoting activity on melon plants. J Chem Ecol. 2014. 40(7), 804-815. doi:10.1007/s10886-014-0478-1
16. Huallpa, R., Céspedes, R., Esprella, B. Evaluación del efecto de biol bovino en la producción y calidad de la avena forrajera (Avena Sativa L.), en época de invierno en la estación experimental Choquenaira, Viacha – La Paz, RIIARn. 2016. 3(3), 103-113. Retrieved from http://www.scielo.org.bo/pdf/riiarn/v3n1/v3n1_a12.pdf.
17. Pomboza-Tamaquiza, P., León-Gordón, O. A., Villacís-Aldaz, L. A., Vega, J., Aldáz-Jarrín, J. C. The influence of biol in the crop yield of Lactuca sativa L. variety Iceberg. J Selva Andina Biosph. 2016. 4(2), 84-92. Retrieved from https://www.ingentaconnect.com/content/doaj/23083867/2016/00000004/00000002/art00005
18. Wong, K. F., Suhaimi, O., Fatimah, K. On-farm grower-friendly nursery technique for acclimatization of tissue-cultured banana seedlings. AJPS. (2017). 3(2),146-151. Retrieved from https://pdfs.semanticscholar.org/3804/285b609c520c71d09798168164158060a5a7.pdf
19. Sosa, T., Sánchez, J., Morales, E., Cruz, F. Arbuscular mycorrhizae-Trichoderma harzianum (Moniliaceae) interaction and effects on Brachiaria decumbens (Poaceae)’s Growth. Acta Biol Colomb. 2006. 11(1), 43-54. Retrieved from http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-548X2006000100004
20. Vera, J. L., Leon, B. Effect of the methods and application rates of Trichoderma viride on acclimatization and growth of vitroplants of potato variety black Imilla during periods of winter and spring. Rev Investig Altoandin. 2016. 18(1), 47-54. doi: 10.18271/ria.2016.177
21. Padrón, R.A., Lopes, S. J., Swarowsky, A., Cerquera, R. R., Nogueira, C.U., Maffei, M. Non-destructive models to estimate leaf area on bell pepper crop. Ciencia Rural. 2016. 46(11),1938-1944. doi: 10.1590/0103-8478cr20151324
22. Neyra, S., Terrones, L., Toro, L., Zárate, B., Soriano, B. Efecto de la inoculación de Rhizobium etli y Trichoderma viride sobre el crecimiento aéreo y radicular de Capsicum annum var. longum. Rebiolest. (2013). 1(1), 11-21. Retrieved from http://revistas.unitru.edu.pe/index.php/ECCBB/article/view/176
23. Martin, P. Echantillonnage du bananier pour I’analyse foliare: Conséquences des différences de techniques. Fruits. 1997. 32(3), 151-166. Retrieved from https://pdfs.semanticscholar.org/faff/4f91db32b3d5c81fff11173ad9a758e1bed2.pdf
24. Phillips, J. M., Hayman, D.S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans Brit Mycol Soc. 1970. 55,158-161. doi: 10.1016/S0007-1536(70)80110-3
25. McGonigle, T. P., Miller, M.H., Evans, D.G., Fairchild, G.L., Swan, J. A. A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New Phytol. 1990. 115(3), 495-501. doi: 10.1111/j.1469-8137.1990.tb00476.x
26. Moya, J., García, S., Avilés, E., Andújar, F., Nuñez, P. Aislamiento de cepas de Trichoderma de suelos, sustratos y raíces de plantas en invernaderos en la República Dominicana. Revista APF. 2014. 3(2), 11-16. Retrieved from https://www.researchgate.net/publication/276355354_Aislamiento_de_cepas_de_Trichoderma_de_suelos_sustratos_y_raices_de_plantas_en_invernaderos_en_la_Republica_Dominicana
27. French, E. R., Hebert, T. T. Aislamiento de fitopatógenos: Matilde M, editor(s). Métodos de Investigación Fitopatológica. San José de Costa Rica: Editorial IICA.1980. p. 154-167.
28. Barrera, V. A. El género Hypocrea Fr. (Hypocreales, Ascomycota) en la Argentina. Estudio de la variabilidad molecular de su estado anamórfico Trichoderma=Hypocrea Fr. (Hypocreales, Ascomycota) in Argentina. Studies on the molecular variability of its anamorphic state Trichoderma. Argentina: Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. 2012. 22-33. Retrieved from https://bibliotecadigital.exactas.uba.ar/download/tesis/tesis_n5226_Barrera.pdf
29. Folli-Pereira, M.D., Meira-Haddad, L.S. Nobre CM, Megumi MC. Plant-Microorganism Interactions: Effects on the Tolerance of Plants to Biotic and Abiotic Stress. In: Hakeem K, Ozturk M, Ahmad P, editor(s). Crop Improvement: New Approaches and Modern Techniques. Boston: Springer-Verlag New York Inc. 2013. p. 209-238. doi: 10.1007/978-1-4614-7028-1_6
30. Bernardo, L., Morcia, C., Carletti, P., Ghizzoni, R., Badeck, F., Rizza, F. Proteomic insight into the mitigation of wheat root drought stress by arbuscular mycorrhizae. J Prot. 2017. 169(3), 21-32. doi: 10.1016/j.jprot.2017.03.024
31. Pérez, U. A., Ramírez, M. M., Zapata, Y.A., Córdoba, J.M. Efecto de la inoculación simple y combinada con hongos formadores de micorriza arbuscular (HFMA) y rizobacterias promotoras de crecimiento vegetal (BPCV) en plántulas micropropagadas de mora (Rubus glaucus L.). Corpoica Cienc. Tecnol. Agropecu. 2015. 6(1), 95-103. doi: 10.21930/rcta.vol16_num1_art:383
32. Rui-Xia, L., Feng, C., Guan, P., Qi-Rong, S., Rong, L., Wei, C. Solubilization of phosphate and micronutrients by Trichoderma harzianum and its relationship with the promotion of tomato plant growth. Plos One. 2015. 10(6), 1-16. doi: 10.1371/journal.pone.0130081
33. Montejo, J. L., Suárez, D. S., Carmenates, J. L., López, P. J. Aplicación de bioestimulantes a vitroplantas de plátano (Musa sp.). Agrisost. 2017. 23(1), 37-44. Retrieved from https://core.ac.uk/download/pdf/268093092.pdf
34. Acosta, E., Galindo, L. Efectos conjuntos de biobrás-16 y diferentes tiempos e intensidades de iluminación en plantas de banano in vitro (Musa spp. CV. FHIA-18) en la fase de aclimatación. Tlatemoani Rev Acad de Invest. 2016. 1(1), 48-62. Retrieved from https://dialnet.unirioja.es/servlet/articulo?codigo=7286074
35. Estrada-Luna, A., Davis., F. Arbuscular mycorrhizal fungi influence water relations, gas exchange, abscisic acid and growth of micropropagated chile ancho pepper (Capsicum annuum) plantlets during acclimatization and post-acclimatization. J Plant Physiol. 2003. 16(9), 1073-1083. doi: 10.1078/0176-1617-00989
36. Quiñones-Aguilar, E. E., López-Pérez, L., Rincón-Enríquez, G. Dinámica del crecimiento de papaya por efecto de la inoculación micorrízica y fertilización con fósforo. Rev. Chapingo ser. Hortic. 2014. 20(2), 223-237. doi: 10.5154/r.rchsh.2013.05.018
37. Villarreal, T. C., Medina, M. E., Ulloa, S. M., Darwin, R., Bangeppagari, M., Selvaraj, T., Sikandar, I. M. Effect of arbuscular mycorrhizal fungi (AMF) and Azospirillum on growth and nutrition of banana plantlets during acclimatization phase. J Appl Pharm Sci. 2016. 6(6),131-138. doi:10.7324/JAPS.2016.60623
38. Barrera-Violeth, J., Oviedo-Zumaque, L. E., Barraza-Álvarez, F. Evaluación de micorrizas nativas en plantas de plátano Hartón (Musa AAB Simmonds) en fase de vivero. Acta biol Colomb. 2012. 61(4), 315-324. Retrieved from https://revistas.unal.edu.co/index.php/acta_agronomica/article/view/38131/40298
39. Castellanos, D. E., Rincón, J.M., Arguello, H. Evaluación del efecto de un biofertilizante ligado a un soporte orgánico mineral en un cultivo de lechuga en la Sabana de Bogotá bajo condiciones de invernadero. Rev Colomb Cienc Hortic. 2015. 9(1):72-85. doi: 10.17584/rcch.2015v9i1.3747
40. Sharma, N., Yadav, K., Aggarwal, A. Synergistic effect of arbuscular mycorrhizae and Trichoderma sp. on growth, nutrient uptake and yield of Phaseolus Mungo L. cultivars. J. Trop. Plant Physiol. 2016. 8, 23-31. Retrieved from http://www.mspp.org.my/files/jtpp/jttpvol8/JTPP%20Vol%208%202016%20page%2023-31%20Phaseolus%20mungo%20(3).pdf
41. Pírela-Almarza, Á.Y., Aguirre-Serpa, O.E., Ramírez-Villalobos, M.C., Petit., B., Bracho, B., Parra, I. Efecto de hongos micorrízicos arbusculares y del estiércol de ovino en el desarrollo inicial de la lechosa (Carica papaya L.) var. Maradol roja. Bioagro. 2018. 30(1), 79-86. Retrieved from http://ve.scielo.org/scielo.php?pid=S131633612018000100008&script=sci_abstract
42. López, A., Espinoza, J. Manual de nutrición y fertilización del banana. Una visión práctica de manejo de la fertilización. Quito, Ecuador: International Plan Nutrition Institute editor. 1995. Retrieved from http://nla.ipni.net/ipniweb/region/nla.nsf/e0f085ed5f091b1b852579000057902e/c093707b0327c2fe05257a40005f359f/$FILE/N%20F%20Banano.002.002.pdf/N%20F%20Banano.pdf
43. Zhao, L., Zhang, Y. Effects of phosphate solubilization and phytohormone production of Trichoderma asperellum Q1 on promoting cucumber growth under salt stress. J Integr Agric. 2015. 14(8),1588-1597. doi: 10.1016/S2095-3119(14)60966-7
44. Kamaruzzaman, M., Rahman, M., Islam, M., Ahmad, M. Efficacy of four selective Trichoderma isolates as plant growth promoters in two peanut varieties. Int J Biol Res. 2016. 4(2),152-156. doi: 10.14419/ijbr.v4i2.6468
45. Navnita, S., Kuldeep, Y., Ashok, A. Growth response of two Phaseolus mungo L. cultivars induced by arbuscular mycorrhizal fungi and Trichoderma viride. Inter J Agr. 2016. 2,1-6. doi: 10.1155/2016/1524304
Recibido: 10 Noviembre 2020
Aceptado: 2 Enero 2021
Andy Fabricio Mora-González1,2; Jaime Alberto Naranjo-Morán1; Alexander Albiño-Quitiaquez1; José Alcides Flores-Cedeño1,2; Rodrigo Oviedo-Anchundia1; Luis Galarza-Romero1; Marisol Vera-Oyague2; Vicente Painii-Montero2; Milton Senen Barcos-Arias1*
1Escuela Superior Politécnica del Litoral, ESPOL, Facultad de Ciencias de la Vida, FCV, Centro de Investigaciones Biotecnológicas del Ecuador, CIBE, Campus Gustavo Galindo. Km. 30.5 vía Perimetral, P.O. Box 09-01-5863, Guayaquil, Ecuador.
2Universidad de Guayaquil, Cdla. Universitaria Salvador Allende. Malecón del Salado entre Av. Delta y Av. Kennedy, 090514, Guayaquil, Guayas, Ecuador.
*Autor para correspondencia: mbarcos@espol.edu.ec, tel.:0990750169, fax: 2850747
Andy Mora-González https://orcid.org/0000-0001-5638-6326
Alexander Albiño-Quitiaquez https://orcid.org/0000-0002-2363-7464
Jaime Naranjo-Morán https://orcid.org/0000-0002-4410-9337
José Flores-Cedeño https://orcid.org/0000-0003-2909-7849
Rodrigo Oviedo-Anchundia https://orcid.org/0000-0001-7986-3711
Luis Galarza-Romero https://orcid.org/0000-0002-2870-4080
Marisol Vera-Oyague https://orcid.org/0000-0001-9382-7012
Vicente Painii-Montero https://orcid.org/0000-0002-8849-1830
Milton Barcos-Arias https://orcid.org/0000-0003-0863-6778



















