Vol 9 No 4 2024-4
Sistema glinfático, barrera hematoencefálica y acuaporinas: su relación con la progresión de los gliomas
Glymphatic system, blood-brain barrier and aquaporins: their relationship with glioma progression
Adriel Mederos Matos 1, Mercedes Zamora Mallet 2, Juan Carlos Piña Napal 3
1 Doctor en Medicina. Especialista de Primer Grado de Oncología. Profesor Instructor.
Hospital Provincial Docente de Oncología “María Curie”, Camagüey, Cuba
Carretera Central Oeste, km 4 1/2, esq. Madam Curie, Camagüey, Cuba
E-mail: drickensvd@gmail.com
https://orcid.org/0000-0002-5557-0452
2 Doctor en Medicina. Especialista de Primer Grado de Medicina General Integral y Neurología. Profesor Instructor. Hospital Militar Central “Carlos J. Finlay”
E-mail: mercedeszamoramallet@gmail.com
https://orcid.org/0009-0005-8271-0042
3 Doctor en Medicina Especialista de Segundo Grado de Bioquímica. Doctor en Ciencias Médicas. Profesor Auxiliar. Universidad de Ciencias Médicas “Carlos J. Finlay”
Camagüey, Cuba
E-mail: jcpina.cmw@infomed.sld.cu, https://orcid.org/0000-0003-1813-4990
DOI: 10.70373/RB/2024.09.04.4
Resumen
Los gliomas constituyen los tumores primarios más frecuentes del cerebro en humanos, siendo caracterizados por su notable capacidad infiltrativa y pronóstico desfavorable, de modo que constituyen un importante problema de salud. En los últimos años se han dilucidado aspectos novedosos de la anatomía, fisiología y bioquímica del encéfalo, que brindan explicaciones a interrogantes otrora no respondidas. Con el objetivo de argumentar la relación de la disfunción del sistema glinfático, la barrera hematoencefálica y los cambios en la expresión de acuaporinas con la progresión de estas neoplasias malignas, se realizó la presente revisión bibliográfica en la que se citaron 42 fuentes científicas escritas en inglés, que incluyen 39 obras alojadas en la base de datos de PubMed, con predominio de artículos originales. Se encontró que la disfunción glinfática y los patrones alterados de expresión de acuaporinas en astrocitos y endotelio vascular se correlacionan con el volumen de edema cerebral peritumoral, el grado de neuroinflamación y la agresividad de la enfermedad. Estos hallazgos descubren una avenida optimista para dirigir los esfuerzos humanos en la lucha contra la enfermedad y demuestran la importancia de la investigación básica para ampliar las perspectivas de las intervenciones profilácticas y terapéuticas, tanto en la dimensión oncoespecífica como paliativa.
Palabras clave: sistema glinfático, barrera hematoencefálica, acuaporinas, glioma, edema cerebral, neuroinflamación.
Abstract
Gliomas represent the most common primary brain tumors in humans. They are characterized by their highly infiltrative behavior and poor prognosis, what makes them a prominent health problem. In recent years novel aspects of brain anatomy, physiology, and biochemistry have been elucidated, and new answers to previously unanswered questions were provided. To argue the relationship between the dysfunction of the glymphatic system, the blood-brain barrier, and alterations in aquaporin expression with the progression of these malignant neoplasms, a literature review was conducted. A total of 42 scientific sources written in English were cited, including 39 works hosted in the PubMed database, with predominance of original articles. It was found that glymphatic dysfunction and imbalanced aquaporin expression in astrocytes and vascular endothelium correlate with peritumoral brain edema volume, the degree of neuroinflammation, and the aggressiveness of the disease. These findings unravel an optimistic avenue to direct human efforts in the fight against the disease and demonstrate the importance of basic research in broadening the perspectives of prophylactic and therapeutic interventions, both in tumor-specific treatment and palliative dimensions.
Keywords: glymphatic system, blood-brain barrier, aquaporins, glioma, brain edema, neuroinflammation
______________________________________________________________________________
Introducción
Los gliomas son un grupo de tumores cerebrales que constituyen mayoría entre los tumores primarios encefálicos del adulto (77 % de todos los cánceres del sistema nervioso central). (1)
Su origen se presume en las células gliales. Existe una amplia variedad de entidades en este grupo con distintos comportamientos clínicos y biológicos, que a lo largo del siglo XX han sido estudiados y clasificados, fundamentalmente, en base a rasgos morfológicos; partiendo desde la obra monumental de Bailey y Cushing de 1929 (primer sistema de clasificación hasta la de la Organización Mundial de la Salud (OMS), de 2007). (2, 3, 4)
El progreso tecnológico ha provisto de métodos para examinar a profundidad el cáncer, tales como la secuenciación de genoma completo (WGS), la secuenciación de exoma completo (WES) y otras capaces de medir las alteraciones del número de copias, secuenciación de mRNA, estado de metilación, etc. En las últimas décadas se han aplicado estas técnicas al estudio de los gliomas difusos y se ha podido evidenciar una gradación del número de mutaciones somáticas desde astrocitomas difusos (~16), astrocitomas anaplásicos (~36) hasta glioblastomas (46-50). (5, 6)
La clasificación de la OMS de 2016 fue la primera en incorporar los avances de la biología molecular al diagnóstico de los gliomas y otros tumores del sistema nervioso central (CNS). No obstante, en la más reciente clasificación (OMS 5ta Edición de 2021) es donde se reconocen por primera vez las diferencias clínicas y moleculares entre gliomas difusos de adultos y niños. Por este motivo, los gliomas se clasifican en glioma de tipo pediátrico y glioma de tipo adulto. (7, 8)
El glioma del adulto se subdivide en tres grupos:
- astrocitoma IDH-mutante
- oligodendroglioma IDH-mutante con codeleción 1p/19q
- glioblastoma IDH-natural. (7, 9)
Aunque el diagnóstico y tratamiento de estas neoplasias ha avanzado en los últimos años con la aplicación de nuevas técnicas de diagnóstico molecular y mejores protocolos de cirugía, radioterapia, quimioterapia y terapia dirigida, los resultados siguen siendo pobres, con una supervivencia de menos del 10 % de los pacientes a los tres años. Entre las explicaciones a este fenómeno se citan la gran capacidad infiltrativa de las células de los gliomas, el diagnóstico tardío, la relación entre el tumor y la barrera hematoencefálica, la disrupción del sistema glinfático y el papel central de la acuaporina 4 como vínculo entre estas alteraciones. (1)
Barrera hematoencefálica
La barrera hematoencefálica (BBB) es una barrera protectora en términos estructurales y funcionales, dotada de bombas de eflujo muy eficientes, cuya función es proteger al cerebro de agentes biológicos, metabolitos tóxicos y otras sustancias dañinas presentes en la sangre. (7)
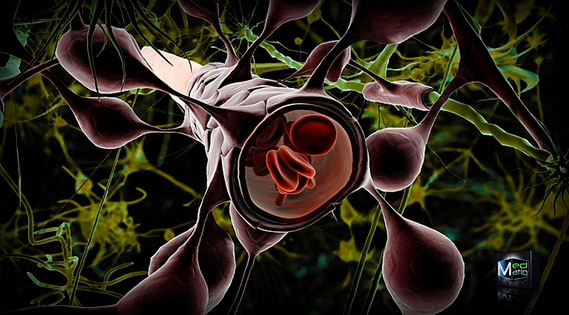
Figura 1. La barrera hematoencefálica es una estructura altamente especializada que está constituida por células endoteliales muy unidas, pericitos, astrocitos y la propia membrana basal.
Esta compleja arquitectura garantiza la homeostasis del cerebro frente a diversos insultos.
Fuente: Ben Brahim Mohammed (dominio público, licencia: Creative Commons), Wikimedia Commons, 2010.
La microvasculatura del CNS tiene varios rasgos únicos: ausencia de fenestraciones entre células endoteliales adyacentes y menor cantidad de vesículas pinocíticas y endocíticas. Los endoteliocitos de la BBB se conectan por una extensión continua de uniones estrechas que restringen la difusión pasiva entre las células endoteliales y a través de la estructura capilar. Además, estas uniones estrechas están envueltas por pies astrogliales lo que limita más aún la difusión pasiva. Como corolario, el endotelio es rico en bombas moleculares efusoras de la familia de las proteínas ABC que incluyen la glicoproteína P codificada por el gen Mdr, la cual elimina activamente sustratos que pueden haber pasado a través de la BBB. (7)
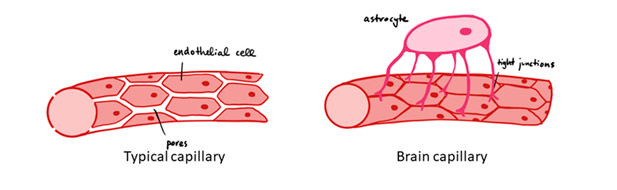
Figura 2. La principal diferencia entre los capilares cerebrales y los capilares de otros tejidos radica en la presencia y complejidad de las uniones estrechas (en inglés, tight junctions), que impiden el paso libre de moléculas y fluidos, sellando de este modo el espacio intercelular endotelial.
Fuente: David Nascari & Alan Sved (dominio público, licencia: Creative Commons), Wikimedia Commons, 2019.
La relación de los tumores cerebrales con esta estructura es un aspecto crítico de su biología con implicaciones directas en su manejo, ya que dificulta el diagnóstico y tratamiento del cáncer por frenar el acceso intracerebral de los medicamentos empleados. Paradójicamente, en la cercanía del tumor se torna permeable a fluidos, lo que provoca edema cerebral vasogénico: la complicación más grave y frecuente del glioblastoma. (1)
El edema vasogénico, al igual que el edema citotóxico inducido por el cáncer, parece depender de alteraciones en la expresión y / o localización de transportadores transmembrana (canales) de agua, pertenecientes a la familia de las acuaporinas. Sin embargo, contrario a lo que puede pensarse, las células endoteliales de los capilares cerebrales sanos no expresan este tipo de proteínas canales. (1)
Antes de produndizar en la fisiopatología del edema cerebral, es necesario comprender las bases de la circulación normal de líquidos en el encéfalo.
Movimiento de fluidos en el cerebro
Una propiedad fundamental de las membranas celulares es su capacidad para permitir un transporte de agua altamente regulado. El transporte de fluidos en los tejidos sigue dos rutas: (1) transcelular: entre la membrana apical y basal de las células, por gradiente osmótico y (2) paracelular: entre los espacios intercelulares, a lo largo de las uniones célula-célula. (1)
Aunque se han encontrado vasos linfáticos en las membranas meníngeas, el parénquima cerebral ha sido considerado tradicionalmente una estructura carente de vasculatura linfática (10), de donde surge la necesidad de considerar vías alternativas para la eliminación de solutos y agua desde el fluido intersticial del espacio extracelular y desde el líquido cefalorraquídeo (CSF). (1)
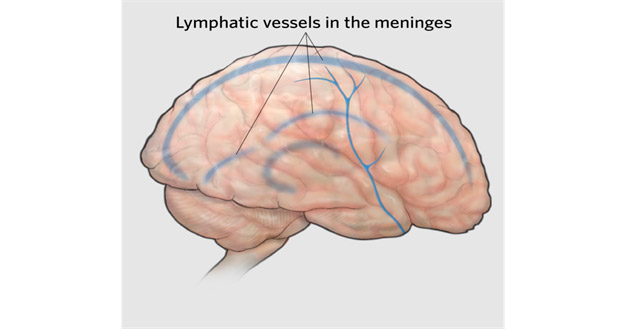
Figura 3. Los vasos linfáticos meníngeos predominan en la duramadre y están estrechamente relacionados con los grandes senos venosos del encéfalo y con los ganglios linfáticos cervicales profundos adonde drenan, lo que permite la eliminación de sustancias a través del sistema linfático general.
Fuente: Mohsin Ajaz (dominio público, licencia: Creative Commons), Wikimedia Commons, 2020.
El CSF es producido por secreción activa de los plexos coroideos y fluye en los ventrículos y el espacio subaracnoideo. En el cerebro, se pueden reconocer cuatro compartimentos de agua distintos: líquido intracelular, líquido extracelular (intersticial), CSF y sangre. La composición del líquido intracelular muestra grandes diferencias entre los distintos tipos celulares, pero el líquido intersticial que rodea a las células cerebrales es similar en composición al CSF, lo cual sugiere una dinámica de intercambio de solutos y agua entre ambos compartimientos. (1)
El estudio de Rennels et al. aportó evidencia, hace casi 40 años, de circulación de CSF hacia el interior del parénquima cerebral mediante “vías paravasculares”, al demostrar la presencia en el espacio extracelular de una proteína trazadora 10 – 20 minutos después de su infusión en los ventrículos laterales y el espacio subaracnoideo de gatos y perros anestesiados. (11)
Hace sólo una década, el trabajo de Iliff y colaboradores, empleando también moléculas trazadoras visualizadas ex vivo mediante imagenología de fluorescencia de cortes fijos de vibrátomo, demostró que, si bien el CSF del compartimiento ventricular penetra muy poco en el parénquima cerebral sólo del tejido periventricular inmediato, el CSF del espacio subaracnoideo difunde rápidamente por el tejido nervioso a lo largo de los espacios paravasculares. (12)
En ese mismo trabajo, los autores hipotetizaron que la acuaporina 4 (AQP4), muy concentrada en los procesos pediculares astrogliales, constituye una vía de baja resistencia al movimiento de fluidos entre los espacios paravasculares y el intersticio, enlazando de este modo el compartimiento de CSF con el líquido intersticial para el aclaramiento de solutos/metabolitos del parénquima cerebral. Para demostrarlo, utilizaron modelos murinos con knockdown global del gen Aqp4 cuyo resultado fue la reducción en un 70 % del aclaramiento de solutos intersticiales; lo cual apoya la hipótesis del transporte astrocítico de fluidos. (12)
Basado en estas observaciones, en la similitud funcional con el sistema linfático periférico y el rol protagónico de las células gliales en el flujo de agua, otros investigadores sugirieron la existencia de una red de intercambio de líquidos, impulsada por la pulsación de las arterias cerebrales, que se denominó sistema glinfático. (1)
Sistema glinfático
Desde 2012, el sistema glinfático ha sido reconocido como una vía de limpieza de residuos y mantenimiento del balance de fluidos en el intersticio del parénquima cerebral. Desde su descubrimiento se ha asociado con el sueño, lo que recalca la importancia de dormir para la salud cerebral (13). Incluso la postura durante el sueño afecta su eficiencia, siendo mayor en decúbito lateral y supino. (14)
Al contrario de lo que ocurre en estados demandantes como el de vigilia donde el cerebro se concentra en tareas que aseguren la supervivencia y el mejor desempeño, durante el sueño los procesos homeostáticos se centran en la restauración, con el objetivo de limpiar los desechos metabólicos generados. En este período, grandes cantidades de CSF son bombeadas al neuropilo (región del tejido nervioso donde se encuentran las sinapsis) en un proceso facilitado por la expansión del volumen extracelular durante el sueño no REM (15). Se ha demostrado que la fracción de volumen intersticial se incrementa hasta un 60 %, lo que permite el aclaramiento de proteína beta-amiloide dos veces más rápido. (16)
Los estudios más recientes aportan evidencia de su relación con el volumen de la materia gris, el desempeño neuropsicológico (13) y ha abierto nuevas perspectivas en la patogénesis de la neurodegeneración, infarto agudo isquémico e incluso en la inmunidad tumoral cerebral, lo que ofrece nuevos horizontes para la terapia personalizada de estas neoplasias. (17)
A pesar de no existir consenso en el concepto de sistema glinfático, puede definirse como una vía paravascular mediada por células gliales y compuesta por tres compartimentos: el espacio perivascular arterial, el compartimiento de intercambio entre líquido cefalorraquídeo e intersticial y el espacio perivascular venoso (18). Los espacios perivasculares, denominados espacios de Virchow-Robins, son cavidades llenas de líquido que se encuentran alrededor de las arterias y venas penetrantes del cerebro. Se tratan de extensiones de la piamadre que acompañan a estos vasos cerebrales en su trayecto. (19)
El CSF del espacio subaracnoideo fluye desde los espacios periarteriales hacia el espacio extracelular y se mezcla con el líquido intersticial del tejido nervioso. La mezcla (denominada fluido neuronal) transita por el intersticio y abandona el parénquima cerebral al entrar a los espacios perivenosos. (17)
Antes del descubrimiento del sistema glinfático no se creía en la posibilidad de esta vía de translocación de fluidos por la presencia de la barrera hematoencefálica (BBB). Una de las revelaciones más importantes en este sentido ha sido que el intercambio de líquidos con el espacio intersticial se lleva a cabo a través de los astrocitos que conforman la BBB, con la AQP4 de los procesos pediculares astrogliales en la base molecular de esta dinámica. (17, 20)
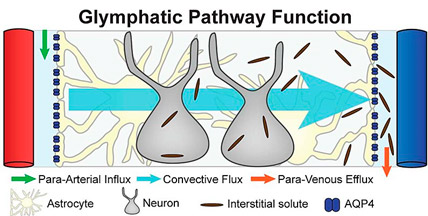
Figura 4. El movimiento de fluidos neuronales en la vía glinfática abarca desde los espacios periarteriales hasta los perivenosos, lo que implica un movimiento transglial y transintersticial.
Fuente: Jeffrey J. Iliff (dominio público), Wikimedia Commons, 2012.
Desde los espacios perivenosos, los fluidos neuronales hacen reentrada al espacio subaracnoideo, desde donde son filtrados por los recién descubiertos vasos linfáticos meníngeos (21), lo que deja entrever la comunicación del sistema glinfático con la circulación linfática tradicional. De esta forma, los solutos y productos de desecho del intersticio neuronal son drenados en última instancia a los ganglios linfáticos cervicales. (17, 20, 21)
Los astrocitos son únicos en su citoarquitectónica, ya que conforman un retículo sincitioide habilitado por uniones mediadas por conexinas entre procesos membranosos de células contiguas. No sólo mueven agua entre los espacios intra- y extracelular, sino también solutos, como lactatos, que son excretados a los espacios paravasculares venosos durante el sueño. Más allá de eso, se considera que los astrocitos son los responsables de la modulación de las fases entre los estados de sueño y vigila. (22)
El estudio del sistema glinfático se lleva a cabo mediante técnicas imagenológicas invasivas, entre las que destaca la resonancia magnética nuclear (MRI) con contraste intratecal de gadobutrol, así como no invasivas, a destacar: resonancia magnética de difusión del espacio perivascular, más conocida como imagenología por tensor de difusión del espacio perivascular (DTI-ALPS), introducida en 2017, de la que deriva el índice ALPS, que refleja la difusividad a lo largo de los espacios perivasculares de las venas medulares al nivel del cuerpo lateral del cuarto ventrículo, por lo que sirve como un estimado de la función del sistema glinfático humano. (23-25)
El índice ALPS se calcula mediante una razón matemática que evalúa la difusividad de las moléculas de agua (i.e.: facilidad con que se mueven estas moléculas a través de un tejido) en los distintos ejes de coordenadas. La fórmula exacta está publicada en el trabajo de Taoka et al. y, aunque su exposición excede los objetivos del presente trabajo, se mostrará una abstracción inédita de la misma para facilitar su comprensión al lector:
Al dividir la difusividad a lo largo de las fibras (eje x) entre la difusividad en las direcciones perpendiculares (ejes y, z), se conoce si la difusión es mayor en una dirección específica. Se asume que una mayor difusividad a lo largo de las fibras (eje x) está relacionada con un mejor flujo de CSF a través de los espacios perivasculares, lo que indica una función más eficiente del sistema glinfático. Los datos de imágenes obtenidas mediante resonancia magnética de difusión se utilizan para realizar reconstrucciones tractográficas, que permiten mostrar una representación visual de los tractos nerviosos a partir de datos recopilados mediante resonancia magnética de difusión. (26)
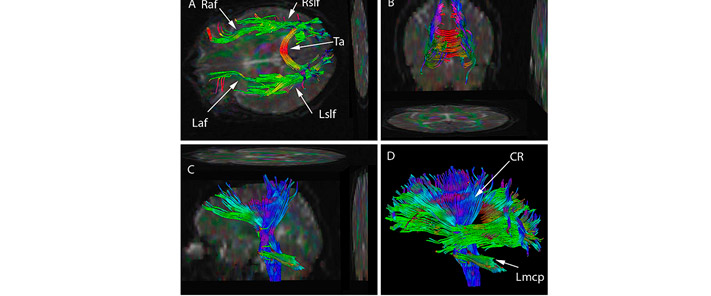
Figura 5. Resonancia magnética de difusión con reconstrucción tractográfica de las fibras nerviosas del encéfalo de un paciente. Esta tecnología permite visualizar las trayectorias de las fibras y crear modelos detallados de las conexiones neuronales.
Fuente: Afiller at English Wikipedia (dominio público, licencia: Creative Commons), Wikimedia Commons, 2009.
La importancia médica del cálculo del índice ALPS no se expresa en términos cuantitativos, sino cualitativos; por tanto, se debe expresar en simples términos de “bajo” o “alto” (25). Se han establecido correlaciones entre índice ALPS con distintas escalas empleadas en hidrocefalia, enfermedad de Alzheimer y otras patologías neurodegenerativas, pero hasta 2021 no se había estudiado en pacientes con glioma. (17)
El trabajo pionero de Toh et al. investigó las correlaciones entre la función glinfática con los volúmenes del edema tumoral y peritumoral, grados tumorales y estado de la mutación IDH en una muestra de 201 pacientes con glioma clasificados como: grado II (43 %), grado III (26 %) y grado IV (31 %); poco más de la mitad de la muestra tenía mutación de IDH1. Los resultados mostraron que el índice ALPS fue significativamente menor en gliomas grado IV en comparación con gliomas grado II/III (sin diferencias entre ellos), así como en gliomas con IDH1 natural (no mutado) en comparación con los mutantes para IDH1, probablemente en relación con edema peritumoral, sin evidenciarse variaciones significativas entre hombres y mujeres. (17)
En otros estudios del mismo autor, también se registran índices bajos cuando existe un volumen marcado de edema peritumoral con independencia de la histología, como en casos de metástasis cerebrales de carcinomas primarios extracraniales (27) o meningiomas (28). Otros investigadores encontraron, en el año en curso, que incluso el hemisferio afectado por el tumor presenta disminución significativa del índice ALPS; a su vez, los resultados no discriminaron en base a edad, sexo o histotipo tumoral. (29)
Las explicaciones propuestas para estas correlaciones se centran en que el crecimiento tumoral rompe el balance entre el influjo de líquido cefalorraquídeo periarterial y el eflujo perivenoso de líquido intersticial, con la acumulación resultante de líquido intersticial y, por ende, edema cerebral peritumoral. La función glinfática normal facilitaría la eliminación del exceso de fluidos y prevendría el edema. Por tanto, la disfunción glinfática permitiría explicar el edema en gliomas y tumores extraaxiales, como los meningiomas, que no tienen contacto directo con el intersticio cerebral. (17)
No obstante, esta teoría no explica la formación de edema peritumoral en gliomas de bajo grado con uniones estrechas intactas, donde está reducido el crecimiento tumoral como agente disruptor del sistema glinfático. En este sentido, un estudio reciente ha demostrado que en estos casos existen cambios en las estructuras de soporte de la BBB que provocan la translocación de fluidos al intersticio cerebral. Los astrocitos parecen ser un paso limitante al movimiento osmótico, donde la AQP4 de sus procesos pediculares juega un papel esencial en la formación de edema peritumoral. La fuerte correlación entre ambos que exhiben diversas investigaciones justifica el estudio del papel de las acuaporinas en condiciones fisiológicas y patológicas. (17)
Acuaporinas y su rol en la vía paravascular de fluidos
Las acuaporinas fueron identificadas por primera vez en 1992 por Peter Agre y colaboradores, como pertenecientes a una familia de transportadores transmembranales (canales) de agua. Las acuaporinas se ensamblan en las membranas como homotetrámeros y forman un arreglo ortogonal de partículas (OAP), donde cada monómero pertenece a una de las dos isoformas principales M1-AQP4 (32 kDa) y M23-AQP4 (30 kDa), y comprende seis dominios α-helicoidales transmembrana y un canal de agua de 2,8 – 3,0 angstroms (Å). (30, 31)
Estas proteínas facilitan el movimiento bidireccional pasivo del agua, impulsado por gradientes osmóticos a través de las membranas, unas 10-100 veces en comparación con la difusión simple. (14, 32)
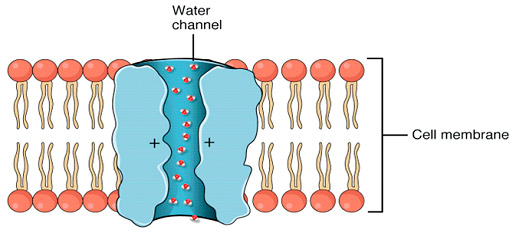
Figura 6. Representación esquemática de una molécula de acuaporina en la membrana celular permitiendo el paso del agua. Estas proteínas integrales de membrana facilitan el transporte rápido y selectivo de agua, lo que es crucial para la regulación del volumen celular y homeostasis.
Fuente: OpenStax College, Anatomy & Physiology, Connexions Web site (dominio público), Wikimedia Commons, 2013.
Los cambios de su actividad tienen implicación en múltiples enfermedades, entre las que se pueden citar epilepsia, accidente vascular encefálico y glioblastoma. Su regulación es muy compleja y ocurre, hasta donde se conoce, por cuatro mecanismos: regulación de la expresión génica por microRNAs, modulación de la apertura del canal mediante fosforilación, control de la permeabilidad al agua por medio iones de metales pesados y regulación también de la permeabilidad mediante inhibidores de pequeña molécula. (33)
Hasta la fecha, se han identificado 11 tipos de acuaporinas en mamíferos en varios órganos como los riñones, glándulas secretoras y el cerebro, donde se describen predominantemente tres miembros de la familia:
- AQP1: se expresa en la membrana apical del epitelio de los plexos coroideos, donde es probable que contribuya a la producción de líquido cefalorraquídeo.
- AQP4: es la acuaporina más abundante y mejor caracterizada del cerebro, y predomina en la membrana plasmática de los astrocitos. La evidencia indica que la AQP4 está anclada en estas membranas a través de interacciones con la α-sintrofina (30). La densidad de AQP4 es particularmente alta en los procesos pediculares de los astrocitos en contacto con los vasos y la lámina basal superficial (100 – 400 / μm2), pero su concentración cae a niveles muy bajos (10 – 20 / μm2) en otras regiones de la membrana astrogial. (1)
- AQP9: se expresa en el revestimiento ependimario del tercer ventrículo, en los astrocitos y las células epiteliales. Pertenece a una subfamilia de acuaporinas, las acuagliceroporinas, que transportan glicerol además de agua, y por lo tanto podrían participar en el metabolismo energético. (30)
Los procesos terminales perivasculares de los astrocitos (procesos pediculares o pies astrogliales) proveen una cobertura prácticamente completa de la microvasculatura cerebral (99 % de la superficie vascular cerebral) (34), dejando sólo hendiduras de 20 – 30 nanómetros (nm), equivalentes a la separación entre dos neuronas en la hendidura sináptica, que permiten una comunicación directa del espacio vascular con el intersticio aunque muy limitada. A pesar de esto, la omnipresente membrana celular astrocitaria interpone una barrera de alta resistencia al flujo entre los compartimientos paravascular e intersticial. En cambio, AQP4, que ocupa el 50 % de la superficie de los pies astrogliales, constituye una vía de baja resistencia al movimiento de agua entre estos compartimientos. (12)
De este modo, impulsado por la presión hidrostática de la masa de fluidos paraarteriales, el movimiento transglial de agua constituye la base del intercambio entre los espacios de Virchow-Robins y intersticio celular. La mezcla de CSF y líquido intersticial (en conjunto denominados fluidos neuronales) es aclarada con sus solutos (como las proteínas beta-amiloides) y transportados a lo largo de vías paravenosas específicas, incluyendo tanto la vena cerebral interna como la vena rinal caudal. Estas venas drenan a la vena cerebral magna y al seno recto (vena cerebral interna) y al seno transverso (vena rinal caudal). (12)
Edema cerebral peritumoral y acuaporinas
Los síntomas de los gliomas son dependientes del crecimiento de la(s) masa(s) tumoral(es) y del edema cerebral peritumoral (PTBE). Desde los años ’90 del pasado siglo se reconocen dos tipos de edema basado en su fisiopatología:
- citotóxico: existen alteraciones en el funcionamiento de la Na⁺/K⁺/ATPasa y acumulación de sodio, con la consiguiente retención de líquidos en el compartimiento intracelular, mientras la BBB permanence intacta.
- Vasogénico: se caracteriza por el compromiso de la BBB y la consecuente pérdida de homeostasia en el microambiente parenquimatoso neuronal. Al aumentar la permeabilidad vascular y la propia integridad de esta barrera, la diferencia de presión hidrostática entre la sangre y el intersticio produce acumulación de líquidos en este último. (1)
Como se ha mencionado antes, AQP4 es una proteína clave en el sistema glinfático que promueve el flujo transglial de fluidos neuronales entre los espacios perivasculares y el intesticio cerebral.
Aunque los estudios de inmunofluorescencia han mostrado que en el área tumoral aumenta la vascularización (aumento de CD34⁺ alpha-SMA⁺), Xu et al. revelaron que la expresión de AQP4 en los pies astrogliales que rodea los vasos tumorales es muy débil. Estos resultados indican que el influjo al intersticio de CSF está limitado en los gliomas. De este modo, los fluidos neuronales no son drenados adecuadamente a las estaciones linfáticas durales, lo que disminuye la exposición de antígenos tumorales a los linfocitos T (18). Otros autores como Kaur han reproducido el hallazgo de subregulación de AQP4 en gliomas como factor vinculado a la obstrucción de los fluidos cerebrales y patogenicidad del cáncer. (20)
No obstante, en aparente contradicción, existen evidencias que apuntan a una relación directa entre los niveles de expresión de AQP4 y la incidencia de crisis cerebrales en pacientes con GBM. Al parecer los pacientes con convulsiones tendrían concentraciones mayores en sus membranas celulares. (1)
A juicio de los autores del presente trabajo, esto deja entrever que el significado biológico de la superexpresión de AQP4 no se ha comprendido en su totalidad. Puede que constituya un factor causal del edema cerebral o, por otro lado, una respuesta tisular compensatoria para eliminar el exceso de líquido. Por esta razón, se precisa comprender en profundidad la fisiopatología de PTBE que, cómo se verá, está íntimamente ligada a la evolución de las neoplasias de la glía.
La entrañable relación entre el edema cerebral peritumoral y la progresión de los gliomas
Todo lo anterior permite afirmar que el PTBE es una entidad multifactorial producida por la combinación de más de un mecanismo fisiopatológico. Es una de las principales manifestaciones de los gliomas que se presenta con varios rasgos histopatológicos: células tumorales infiltrantes, astrocitos reactivos, microglias activadas y angiogénesis. En efecto, la agresividad de los gliomas se correlaciona más con el volumen del edema que con el tamaño tumoral; se sospecha que el edema promueve la invasión glial y que su magnitud se asocia a mayores tasas de recurrencia y peor pronóstico. (35)
A favor de esta sentencia se posiciona la fisiopatología del PTBE, que depende de cuatro mecanismos principales:
- aumento de la permeabilidad de la BBB,
- angiogénesis tumoral,
- superexpresión de AQP4,
- invasión perivascular. (35)
La BBB es responsable de la entrada y salida de fluidos cerebrales, con un balance diario estimado de 40 000 moles de agua. Cualquier factor que provoque aumento de su permeabilidad producirá edema cerebral. Su compromiso es parte indisoluble de la historia natural del glioma en distintas etapas de la enfermedad. Inicialmente, los vasos sanguíneos existentes sirven como una guía para la invasión tumoral; en etapas posteriores, los vasos neoformados dan soporte al crecimiento del tumor, que conlleva secreción de factores angiogénicos (e.g.: VEGF), metaloproteinasas de matriz (MMPs) y ciclooxigenasa-2 (COX-2), los que incrementan la permeabilidad de la BBB. (34, 35)
La concentración de VEGF está influenciada por múltiples oncogenes, genes supresores tumorales, hormonas, citoquinas y varias moléculas de señalización (e.g.: óxido nítrico), y su efecto principal es la inducción de angiogénesis tumoral. Los vasos tumorales neoformados no poseen una BBB con las características normales observadas en vasos cerebrales sanos: expresión reducida de ocludina, claudina-5, cadherina, ZO-1 y ZO-2 (proteínas 1 y 2 de zonnula occludens), así como otras moléculas de adhesión funcional que mantienen las uniones estrechas en el endotelio sano. (34, 35)
Además de la relación de acuaporinas con el edema cerebral, hay estudios que las vinculan con la agresividad del cáncer. Se ha documentado relación directa entre los niveles de AQP4 y el metabolismo glicolítico bajo condiciones hipóxicas, así como el grado de motilidad e invasividad celular. Las células de gliomas son extremadamente invasivas: su dinámica les permite ajustar su propio volumen y atraviesan el parénquima normal pasando por espacios estrechos y tortuosos, siguiendo un gradiente osmótico generado por acuaporinas. (1)
El estudio de Lan et al. demuestra que, si bien la expresión génica de Aqp4 no difiere significativamente en base a la edad, sexo, mutación IDH o mutación MGMT, sí se vinculó con inestabilidad microsatelital (MSI) sin carga mutacional tumoral, score inmunológico y score estromal. El factor MSI, a diferencia de lo que ocurre en otros tumores, se relaciona con mal pronóstico en gliomas. El mismo estudio encontró que AQP4 se encontraba en proporcionalidad directa con la expresión de varios puntos de control inmunitarios y en proporcionalidad inversa con la capacidad de presentación de antígenos por parte del sistema inmunitario. Mediante estos hallazgos, los autores afirman en su estudio que existe relación directa entre AQP4 y la invasividad y resistencia multidroga de los gliomas. (36)
En opinión de los autores, la significación biológica en aparente ambigüedad de la sobreexpresión de AQP4 puede esclarecerse en relación con el histotipo de su expresión. Si bien el patrón de subregulación en astrocitos es característico, en otros tipos celulares (quizás en las propias células tumorales) la superexpresión sea la regla. En el primer caso se vería propiciada la disfunción glinfática, en el segundo, el edema vasogénico con / sin edema citotóxico; ambos trastornos están descritos en la esfera clínica como actores sinérgicos protagonistas del detrimento de la supervivencia y calidad de vida de los pacientes.
En relación a AQP1, Maugeri y colaboradores no sólo le atribuyen un papel en el PTBE de astrocitomas de alto grado, sino que también definen una proporción entre la expresión de AQP1 y el grado de malignidad. Es interesante que la expresión de esta proteína ocurre en la superficie de células endoteliales de capilares cerebrales tumorales, no en controles sanos, por lo que se ha vinculado con la formación de edema vasogénico peritumoral. Para explicar esto, sugieren que AQP1 induciría la secreción apocrina de VEGF por las células tumorales, lo que aumentaría la permeabilidad vascular secundaria a angiogénesis (1), además, por el hecho de que los vasos tumorales neoformados contienen una BBB disfuncional, como antes se ha descrito. (35)
Maugeri también explica el papel de la hipoxia en la regulación del VEGF a nivel transcripcional y en la inducción de glucólisis anaerobia y producción de ácido láctico por el tumor, que puede persistir incluso en condiciones normóxicas (efecto Warburg). En éste y otros estudios se sugiere que la disminución del pH intracelular promueve la extrusión de hidrogeniones al espacio extracelular en conjunto con moléculas de agua, lo que induciría la superexpresión de AQP1 por el endotelio, como mecanismo compensatorio. Por tanto, los niveles de AQP1 vascular se correlacionarían con la intensidad de la glucólisis anaerobia tumoral. (1)
En opinión de los autores, un elemento fisiopatológico que refuerza la hipoxia, y en última instancia, el propio edema, es, paradójicamente, el propio proceso angiogénico. Está descrito que la angiogénesis tumoral nunca restablece la normoxia, más bien perpetúa la hipoxia relativa. Por un lado, esto es debido al crecimiento neoplásico no emparejado por el vascular, y por otro, a las cualidades tortuosas, irregulares, de los vasos neoformados, que no permiten un suministro adecuado de oxígeno al estroma y, aun en la cercanía de las células, se mantiene un grado de hipoxia intracelular relativa que mantiene encendidos estos circuitos patogénicos de retroalimentación positiva. La hipoxia es, además, acentuada por el edema pericelular que expande el espacio extracelular y disminuye la presión parcial tisular de oxígeno. Esta asociación viciosa generaría edema por varios mecanismos, incluyendo el del edema citotóxico.
Algo muy interesante que otros investigadores describen es el hallazgo de elementos de respuesta a esteroides en el promotor del gen Aqp1, lo que podría explicar en parte la acción antiedema cerebral de los glucocorticoides. (1)
También se ha reportado que VEGF estimula la producción de AQP4. En este contexto, VEGF sería el verdadero inductor del edema vasogénico, mientras la redistribución de AQP4 representaría una reacción protectora con el objetivo de evitar el edema citotóxico secundario mediante la reabsorción del exceso de fluidos. (1)
Por otro lado, estudios separados de varios autores apuntan a un mecanismo que conecta el PTBE con la invasividad celular: el aumento de influjo celular de agua estimularía la protrusión de la membrana para formar lamelipodios celulares que permiten la migración celular. Los autores hipotetizan que las células de gliomas tienen una habilidad inusual para regular su volumen y ajustarse a los espacios extracelulares tortuosos en la medida que los invaden, y esto requiere una permeabilidad aumentada al agua. (37, 38)
La invasión perivascular por el tumor puede interferir con el funcionamiento de las vías fisiológicas de drenaje de fluidos, como el sistema glinfático, lo que exacerba en potencia el PTBE (35). En este sentido, Ma y colaboradores demostraron en roedores con glioma una reducción significativa de seis veces del flujo linfático en los grupos de linfonodos cervical profundo y mandibular, sitios terminales del drenaje de CSF de la cavidad craneana. (39)
El estudio de Watkins et al. demuestra que durante la progresión, las células tumorales se asocian con vasos sanguíneos mostrando preferencia por los capilares (< 7 μm de diámetro) que constituyen un 48 % de la superficie vascular total; sólo un tercio de las células se anclaron a los vasos arteriales/venosos perforantes (7-35 μm de diámetro, 51 % del área total de los vasos); el resto, muy pocas células, contactaron vasos de mayor calibre para sólo un 1 % del área medida. Esta predilección por los pequeños vasos evoluciona al desplazamiento por parte del glioma de los procesos pediculados astrogliales hasta llegar a un contacto directo con las células endoteliales. Este insulto tiene consecuencias inmediatas en la modulación de las uniones estrechas del endotelio: la presencia de una sola célula cancerosa puede reducir la expresión de ZO-1 y claudina-5. (34)
En opinión de los autores del presente trabajo resulta evidente la entrañable relación entre el edema y la progresión de la enfermedad. Cada uno de los cuatro mecanismos fisiopatológicos citados al inicio de esta sección guardan vínculo con el desarrollo del glioma y llegan a su punto culminante con el desacoplamiento de los pies astrogliales de la superficie vascular por parte del glioma, la disrupción del sistema glinfático y la integridad de la barrera hematoencefálica. Al interrumpir in situ la vía transglial de los fluidos neuronales y, en consecuencia, el bloqueo glinfático en intima connexio con el estado de neuroinflamación (como se verá más adelante), el tumor asegura su desarrollo en condiciones tóxicas que le favorecen. Su crecimiento compromete la BBB en términos funcionales en un inicio, debido a la angiogénesis y al rol permeabilizante del VEGF, mas la injuria se completa cuando invade la vasculatura e induce cambios estructurales al desplazar los astrocitos y degradar las uniones estrechas endoteliales. El resultado clínicamente evidente de todo este proceso es el edema cerebral peritumoral, con pronóstico sombrío a mediano y corto plazo por el desarrollo eventual de síndrome de hipertensión endocraneana.
Disfunción glinfática y neuroinflamación: círculo vicioso ignitor del glioma
El bloqueo glinfático, sumado a la disminución de producción de CSF asociado a PTBE e hipertensión endocraneana, compromete en gran medida el recambio de fluidos en pacientes con glioblastoma, lo que conduce al acúmulo de proteínas tóxicas, solutos y citoquinas/quimioquinas proinflamatorias que promueven la progresión de los gliomas. (39, 40)
De hecho, el estado de neuroinflamación y la disfunción glinfática, en muchos casos, coexisten y se contribuyen mutuamente desde el punto de vista causal, formando un círculo vicioso de injuria cerebral. El drenaje disminuido de CSF y/o la disfunción del sistema glinfático afectan la capacidad de eliminar los mediadores inflamatorios. Del mismo modo, la neuroinflamación puede exacerbar el daño glinfático; en este sentido, se sugiere que la liberación descontrolada de trampas extracelulares de neutrófilos (NETs) puede producir obstrucción vascular y daño tisular (40). Una evidencia a favor de este mecanismo patogénico es el hallazgo de Pavan y colaboradores, que condujeron un estudio exploratorio de la patogenia del edema cerebral debido a meningitis por Streptococcus pneumoniae en un modelo murino; encontraron que las NETs interfieren con el transporte de fluidos neuronales mediado por el sistema glinfático, lo que conduce en última instancia al desarrollo eventual de edema cerebral difuso; demostraron que la degradación de las NETs con DNAsas revirtió el daño glinfático y restauró la dinámica de fluidos. (41)
Los autores opinan que este pasaje demuestra el carácter de arma de doble filo del sistema inmunológico, capaz de provocar daños colaterales al propio hospedero, en ausencia de una enfermedad autoinmune. También resulta evidente una característica de la evolución humana: los mecanismos homeostásicos que son eficientes en condiciones agudas, se vuelven patogénicos en condiciones crónicas. El ser humano destaca en el mundo vivo por la disarmonía entre su propia biología y el ambiente que habita (el medio social: su segunda naturaleza), y esta disonancia de habitar en un mundo en permanente cambio por la cultura, que supera su capacidad de adaptación biológica (e incluso intelectual), es la principal fuente de patogenicidad de las enfermedades crónicas no trasmisibles.
Desde el punto de vista inmunitario, con el bloqueo del drenaje de CSF se afecta el transporte hacia los linfonodos de antígenos tumorales, lo que compromete la activación y proliferación de linfocitos T citotóxicos; no es extraño suponer entonces que el glioblastoma progresa en un microambiente privilegiado. Hay evidencias, además, de que la circulación interrumpida de CSF podría atenuar la eficacia de la administración de drogas intratecales a la cavidad craneana. (39)
Direcciones futuras en el tratamiento de gliomas
Hasta el presente, varios medicamentos se usan para el tratamiento del edema cerebral peritumoral (PTBE). Entre los más importantes: la esteroidoterapia y la osmoterapia con manitol; esta última incrementa la presión coloidosmótica intravascular que conduce a la retirada de agua de los tejidos cerebrales en cuestión de minutos. No obstante, las recientes revelaciones en la patogenia y fisiopatología de estas neoplasias malignas y sus fenómenos asociados pueden pavimentar el camino hacia la exploración de nuevas perspectivas terapéuticas.
Dado el rol de la AQP1 en el edema cerebral vasogénico y en la perpetuación de la hipoxia relativa, angiogénesis, crecimiento e invasión tumorales, el desarrollo de terapias biológicas contra esta diana podría romper el círculo vicioso que promueve la progresión tumoral. Su uso combinado con microdosis controladas de esteroides y dosis convencionales de anticuerpos monoclonales humanizados dirigidos contra el endotelio vascular (e.g.: bevacizumab), podría profundizar la regresión vascular y el efecto antitumoral, además de prevenir el edema peritumoral en un contexto de citólisis que podría favorecerlo.
En cambio, la explotación de la AQP4 parece propiciar una mayor controversia, pues su patrón de expresión y su significación biológica no están del todo dilucidadas. Terapias que induzcan la restauración de la AQP4 podría, como afirman autores como Xu, restablecer el comprometido sistema glinfático locorregional en pacientes con glioma, lo que aliviaría la obstrucción a la salida de fluidos neuronales y, por consiguiente, promovería la inmunidad antitumoral y el suministro más eficiente de agentes biológicos. Sin embargo, su inducción podría aumentar el edema peritumoral como afirman otros investigadores, en estrecha relación con la progresión de la enfermedad. Es posible que la inducción de expresión de AQP4 (si no se lleva a cabo controladamente en los procesos pediculados astrogliales mediante liposomas u otros mecanismos), no pueda ejercerse en la práctica clínica sin el bloqueo simultáneo de la AQP1 (y quizás, de la propia AQP4 en otros sitios) y/o agentes antiangiogénicos y/o esteroides.
El uso de inhibidores de COX-2, investigado hace décadas en otros tumores, pudiera ser parte de las terapias antiangiogénicas empleadas en el futuro; sin embargo, sus efectos adversos cardiotóxicos podrían prohibir su uso en ciertos pacientes, en especial en combinación con bevacizumab. En este sentido, estaría justificada la investigación de otros agentes de la misma vía del ácido araquidónico, capaces de modular la permeabilidad vascular de la BBB: los leucotrienos y las lipooxigenasas.
El trabajo experimental de Pavan et al. sobre el uso de DNAsas para revertir la neuroinflamación en el contexto de meningitis bacteriana, podría extrapolarse a determinados escenarios del tratamiento de los gliomas, dado su potencial para romper el círculo de retroalimentación positiva entre la disfunción glinfática y el estado inflamatorio. El beneficio de su uso podría ampliarse en combinación con otros agentes empleados para el tratamiento del edema cerebral, tanto en la fase aguda como en terapias de mantenimiento con intención paliativa.
El empleo de algunos compuestos derivados de la Medicina Complementaria y Alternativa (MCA), más conocida como Medicina Natural y Tradicional (MNT), pudiera ser una alternativa o complemento en el objetivo común de los tratamientos anticáncer. En este sentido se cita al goreisan, empleado en Japón, China y otras naciones asiáticas en el tratamiento de migraña y otras cefaleas, cuyo rol en la modulación de AQP4 y PTBE es un campo activo de investigación (42). Otros compuestos, esta vez de la India, incluyen los ácidos boswélicos derivados de Boswellia serrata, que exhiben propiedades antiinflamatorias de utilidad en el manejo del edema cerebral, así como propiedades antitumorales y antioxidantes que ameritan mayor estudio (35). La investigación y aplicación de la MNT podría tener impacto en un espectro amplio desde el tratamiento de urgencias en unidades de cuidados críticos o intermedios, como complemento o sustitución de terapias actuales en pacientes específicos, a la terapia metronómica de gliomas cerebrales o su uso paliativo en el escenario de progresión de la enfermedad.
Por otro lado, la inducción de estructuras linfoides terciarias podría mejorar la inmunidad antitumoral. Las estructuras linfoides terciarias son agregados ectópicos de células linfoides (B y T) y estromales que se forman transitoriamente en ambientes carentes de tejido linfoide en asociación con condiciones inflamatorias crónicas, incluyendo autoinmunidad y cáncer. Su maduración se cree que abarca un espectro desde simples cúmulos linfoides hasta estructuras organizadas que contienen folículos definidos de células B con centro germinal activo así como zonas periféricas de células T, remedando órganos linfoides secundarios. (10)
El desarrollo de terapias avanzadas como las hipotetizadas no podría considerarse separado de ciertos procedimientos paliativos, clínicos o quirúrgicos, que restablezcan la circulación normal del líquido cefalorraquídeo. Es posible que estas terapias u otras menos invasivas aumenten sus indicaciones y no se releguen sólo a la dimensión paliativa del manejo del cáncer.
El enfoque de la medicina preventiva no estaría exento de beneficiarse de estudios más profundos en relación a las acuaporinas. El desarrollo de nuevos biomarcadores para detectar fases muy tempranas de la enfermedad (subclínica) tendrían un impacto incuestionable en la supervivencia de pacientes con glioma.
Del mismo modo, el uso de estos (futuros) biomarcadores podría emplearse como guía para la evaluación de la respuesta en terapias sistémicas y en la detección precoz de recidivas. En este sentido, el estudio funcional mediante resonancia nuclear de difusión con medición de índice ALPS podría beneficiar a pacientes controlados en seguimiento, al anunciar tempranamente la disfunción del sistema glinfático aun en ausencia de evidencia clínica o imagenológica. (anatómica).
Conclusiones
El tratamiento de los gliomas cerebrales y sus fenómenos asociados aún representa un gran desafío tanto en la esfera asistencial como en la investigativa. No obstante, la revelación de aspectos fisiológicos del encéfalo que permanecían elusivos (e.g.: sistema glinfático), así como de mecanismos fisiopatológicos de fenómenos asociados a la progresión de los gliomas, descubre una avenida optimista para dirigir los esfuerzos humanos en la lucha contra la enfermedad.
El descubrimiento, aunque no del todo dilucidado, del papel de las acuaporinas en estos fenómenos, se suma a las continuas aseveraciones de la importancia de la investigación básica para ampliar las perspectivas del tratamiento oncoespecífico y paliativo, así como de la profilaxis secundaria.
No se deben dejar de mencionar los beneficios indudables de la incorporación de la medicina complementaria y alternativa a la asistencia médica y a la investigación; la fusión de ambos esfuerzos en una medicina de nuevo tipo podría acelerar el hallazgo de soluciones a los problemas de salud del presente.
Author Contributions: Todos los autores contribuyeron de manera similar en la preparación del artículo.
Funding: No se recibieron fondos para este trabajo de revisión.
Institutional Review Board Statement: No aplica
Informed Consent Statement: No aplica
Data Availability Statement: No aplica
Conflicts of Interest: Los autores declaran no tener conflictos de interés
Acknowledgments: No aplica
Referencias bibliográficas
- Maugeri R, Schiera G, Di Liegro CM, et al. Aquaporins and Brain Tumors. Int. J. Mol. Sci. 2016;17:1029. doi: 3390/ijms17071029
- Kernohan JW, Mabon RF, et al. A simplified classification of the gliomas. Proc Staff Meet Mayo Clin 1949;24(3):71-75.
- Kalidindi N, Or R, Babak S, et al. Molecular Classification of Diffuse Gliomas. Can J Neurol Sci. 2020;47:464-473. doi: 1017/cjn.2020.10
- Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta neuropathol 2016;13:803-20. doi: 1007/s00401-016-1545-1
- Otani R, Uzuka T, Ueki K. Classification of adult diffuse gliomas by molecular markers -a short review with historical footnote. Japanese Journal of Clinical Oncology 2017;47(1):2-6. doi: 1093/jjco/hyw142
- Killela PJ, Pirozzi CJ, Reitman ZJ, et al. The genetic landscape of anaplastic astrocytoma. Oncotarget 2014;5:1452-1457. doi: 18632/oncotarget.1505
- Youngblood MW, Magill ST, Stupp R, et al. Neoplasms of the Central Nervous System. En: DeVita VT, Lawrence TS, Rosenberg SA. DeVita, Hellman, and Rosenberg’s Cancer Principles and Practice of Oncology. Philadelphia: Wolters Kluwer. Vol 5. Cap. 60. pp1263-1332.
- Youngblood MW, Moliterno GJ, Grünel M. Molecular Biology of Central Nervous System Tumors. En: DeVita VT, Lawrence TS, Rosenberg SA. DeVita, Hellman, and Rosernberg’s Cancer Principles and Practice Cap. 28. pp1021-1042.
- Louis DN, Ellison DW, Perry A, et al. Introduction to CNS tumors. En: WHO Classification of Tumors Editorial Board. Central Nervous System Tumours. Lyon: International Agency for Research on Cancer. 5ta edición. Cap. 1. pp1-14.
- van der Walle T, Vaccaro A, Ramachandran M, et al. Tertiary Lymphoid Structures in the Central Nervous System: Implications for Glioblastoma. Frontiers in Immunology 2021(12);724739. doi: 3389/fimmu.2021.724739
- Rennels ML, Gregory TF, Blaumanis OR, et al. Evidence for a ‘Paravascular’ Fluid Circulation in the Mammalian Central Nervous System. Brain Research 1985;326:47-63. doi: 1016/0006-8993(85)91383-6
- Iliff JJ, Wang M, Zeppenfeld DM, et al.. Cerebral arterial pulsation drives paravascular CSF-interstitial fluid exchange in the murine brain. J. Neurosci. 2013;33:18190–18199. doi: 1523/JNEUROSCI.1592-13.2013
- Siow TY, Toh CH, MD, Hsu JL. Association of Sleep, Neuropsychological Performance, and Gray Matter Volume With Glymphatic Function in Community-Dwelling Older Adults. Neurology 2022;98(8):e829-e838. doi: 1212/WNL.0000000000013215
- Mogensen FLH, Delle C, Nedergaard M. The Glymphatic System (En)during Inflammation. Int. J. Mol. Sci. 2021;22:7491. doi: 3390/ijms22147491
- Rasmussen MK, Mestre H, Nedergaard M. Fluid Transport in the Brain. Physiol Rev 2002;102:1025-1151. doi: 1152/physrev.00031.2020
- Eide PK, Vinje V, Pripp AH, et al. Sleep deprivation impairs molecular clearance from the human brain. Brain 2021;144:863–874. doi: 1093/brain/awaa443
- Toh CH, Tiing YS. Factors Associated With Dysfunction fo Glymphatic System in Patients With Glioma. Frontiers in Oncology 2021(11):624690. doi: 3389/fnins.2021.624690
- Xu D, Zhou J, Mei H, et al. Impediment of Cerebrospinal Fluid Drainage Through Glymphatic System in Glioma. Frontiers in Oncology 2022(11);790821. doi: 3389/fonc.2021.790821
- Ferris CF. Rethinking the Conditions and Mechanism for Glymphatic Clearance. Frontiers in Neuroscience 2021(15):624690. doi: 3389/fonc.2021.744318
- Kaur J, Ding G, Zhang L, et al. Imaging glymphatic response to glioblastoma. Cancer Imaging 2023;23:107. doi: 1186/s40644-023-00628-w
- Louveau A, Smirnov I, Keyes T, et al. Structural and functional features of central nevous system Lymphatics. Nature 2015;523(7560):337-341. doi: doi:10.1038/nature14432
- Lee DS, Suh M, Sarker A, et al. Brain Glymphatic/Lymphatic Imaging by MRI and PET. Nucl Med Mol Imaging 2020;54:207–223. doi: 1007/s13139-020-00665-4
- Eide K. Neurosurgery and the glymphatic system. Acta Neurochirurgica 2024;166:274. doi: 1007/s00701-024-06161-4
- Steward CE, Venkatraman VK, Lui E, el al. Assessment of the DTI-ALPS Parameter Along the Perivascular Space in Older Adults at Risk of Dementia. J Neuroimaging 2021;31:569-578. doi: 1111/jon.12837
- Taoka T, Ito R, Nakamichi R, et al. Diffusion Tensor Image Analysis ALong the Perivascular Space (DTI-ALPS): Revisiting the Meaning and Significance of the Method. Magn Reson Med Sci 2024;23:268–290. doi: 2463/mrms.rev.2023-0175
- Basser PJ, Pajevic S, Pierpaoli C, et al. In Vivo Fiber Tractography Using DT-MRI Data. Magnetic Resonance in Medicine 2000;44:625–632. doi: 1002/1522-2594
- Toh CH, Siow TY, Castillo M. Peritumoral Brain Edema in Metastases May Be Related to Glymphatic Dysfunction. Frontiers in Oncology 2021(11);725354. doi: 3389/fonc.2021.725354
- Toh CH, Siow TY, Castillo M. Peritumoral Brain Edema in Meningiomas May Be Related to Glymphatic Dysfunction. Frontiers in Neuroscience 2021(15);674898. doi: 3389/fnins.2021.674898
- Villacis G, Schmidt A, Rudolf J, et al. Evaluating the glymphatic system via magnetic resonance diffusion tensor imaging along the perivascular spaces in brain tumor patients. Japanese Journal of Radiology 2024;42:1146-1156. doi: 1007/s11604-024-01602-7
- Amiry-Moghaddam M, Ottersen OP. The Molecular Basis of Water Transport in the Brain. Nature Reviews Neuroscience 2003(4):991-1001. doi: 1038/nrn1252
- Pisani F, Simone L, Mola MG, et al. Regulation of aquaporin-4 expression in the central nervous system investigated using M23-AQP4 null mouse. Glia. 2021;69:2235–2251. doi: 1002/glia.24032
- Verkman AS, Mitra AK. Structure and function of aquaporin water channels. Am. J. Physiol. Renal Physiol. 2000;278:F13-F28. doi: 1152/ajprenal.2000.278.1.f13
- Vandebroek A, Yasui M. Regulation of AQP4 in the Central Nervous System. Int. J. Mol. Sci. 2020;21:1603. doi: 3390/ijms21051603
- Watkins S, Robel S, Kimbrough IF, et al. Disruption of astrocyte-vascular coupling and the blood-brain barrier by invading glioma cells. Nat Commun. 2014;5:4196. doi: 1038/ncomms5196
- Ohmura K, Tomita H, Hara A. Peritumoral Edema in Gliomas: A Review of Mechanisms and Management. Biomedicines 2023;11:2731-2746. doi: 3390/biomedicines11102731
- Identification of the prognostic and immunological roles of aquaporin 4: A potential target for survival and immunotherapy in glioma patients. Frontiers in Cellular Neuroscience 2022(16):1061428. doi: 3389/fncel.2022.1061428
- McCoy E, Sontheimer H. Expression and function of water channels (aquaporins) in migrating malignant astrocytes. Glia 2007;55:1034–1104. doi: 1002/glia.20524
- Papadopoulos MC, Saadoun S. Key roles of aquaporins in tumor biology. Biochim. Biophys. Acta 2015;1848:2576–2583. doi: 1016/j.bbamem.2014.09.001
- Ma Q, Schlegel F, Bachmann SB, et al.. Lymphatic outflow of cerebrospinal fluid is reduced in glioma. Scientific Reports 2019;9:14815. doi:1038/s41598-019-51373-9
- Zou K, Deng Q, Zhang H, et al. Glymphatic system: a gateway for neuroinflammation. Neural Regeneration Research 2024;19(12):2661-2672. doi: 4103/1673-5374.391312
- Pavan C, Xavier ALR, Ramos M, et al. DNAse treatment prevents CSF block in early experimental pneumococcal meningitis. Ann Neurol 2021;90(4):653-669. doi: 1002/ana.26186
- Iba C, Unekawa M, Izawa Y. Effect of Goreisan, a Japanese Traditional Medicine, on Cortical Spreading Depolarization in Mice. Int. J. Mol. Sci. 2022; 23:13803. doi: 3390/ijms232213803
Anexo 1. Glosario
| Acrónimo | Significado | Traducción común |
| AQP | aquaporin | acuaporina |
| BBB | blood-brain barrier | barrera hematoencefálica |
| CNS | central nervous system | sistema nervioso central |
| CSF | cerebrospinal fluid | líquido cefalorraquídeo |
| DNAsa | deoxyribonuclease | desoxirribonucleasa |
| DTI-ALPS | diffusion tensor imaging analysis along the perivascular space | imagenología por tensor de difusión del espacio perivascular |
| GBM | glioblastoma | glioblastoma |
| IDH | isocitrate dehydrogenase | deshidrogenasa de isocitrato |
| MMP | matrix metalloproteinase | metaloproteinasa de matriz |
| MGMT | O6-methylguanine-DNA methyltransferase | metiltransferasa de O6-metilguanina de ADN |
| MRI | magnetic resonance imaging | resonancia magnética nuclear |
| MSI | microsatellite instability | inestabilidad de microsatélites |
| OAP | orthogonal array of particles | arreglo ortogonal de partículas |
| NET | Neutrophil Extracelullar Traps | Trampas extracelulares de neutrófilos |
| PTBE | peritumoral brain edema | edema cerebral peritumoral |
| REM | rapid eye movement | movimientos oculares rápidos |
| mRNA | messenger ribonucleic acid | ácido ribonucleico (ARN) mensajero |
| VEGF | vascular endothelial growth factor | factor de crecimiento del endotelio vascular |
| Received: 10 octubre 2024 | Accepted: 17 noviembre 2024 | Published: 15 diciembre 2024 |
Citation: Mederos-Matos, A., Zamora M., Piña, JC. Glymphatic system, blood-brain barrier and aquaporins: their relationship with glioma progression. . Bionatura. 2024 Volume 9. No 4.
Peer review information: Bionatura thanks the anonymous reviewers for their contribution to the peer review of this work using https://reviewerlocator.webofscience.com/
All articles published by Bionatura Journal are freely and permanently accessible online immediately after publication, without subscription charges or registration barriers.
Publisher’s Note: Bionatura stays neutral concerning jurisdictional claims in published maps and institutional affiliations.
Copyright: © 2024 by the authors. Submitted for possible open access publication under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/)



















