Vol 9 No 3 2024-10
Hidrólisis enzimática de almidón con α-amilasa en la industria azucarera
Enzymatic starch hydrolysis with α-amylase in the sugar industry
Saúl Dueñas Casas 1, *, Héctor Luis Ramírez 2, Leissy Gómez Brizuela 3, Jesús Luis Orozco 4
1Universidad de Matanzas, Matanzas, Cuba; saul33dc@gmail.com. ORCID (https://orcid.org/.0000-0002-8878-5484).
2Universidad de Matanzas, Matanzas, Cuba; hectorl.ramirez@umcc.cu . ORCID (https://orcid.org/.0000-0003-1383-5149).
3Universidad de Matanzas, Matanzas, Cuba; leissy.gomez@umcc.cu. ORCID (https://orcid.org/.0000-0003-4832-7160).
4Universidad de Matanzas, Matanzas, Cuba; jesus.luis@umcc.cu. ORCID (https://orcid.org/.0000-0001-6484-0672).
*Correspondencia: saul33dc@gmail.com; Tel.: (53) 55061900
DOI: 10.70373/RB/2024.09.03.10
Resumen
El objetivo de la presente investigación es determinar la corriente de aplicación del proceso de hidrólisis enzimática con α-amilasa en la producción de azúcar crudo, para ello se desarrolló un análisis y diseño de experimentos de superficie de respuesta. Bajo las condiciones de estudio la enzima demostró ser efectiva en el desdoblamiento del almidón con porcentajes de remoción entre un 83 y 99 %. Se logró ajustar un modelo de regresión lineal múltiple que explica el 75,96 % de la variabilidad del contenido de almidón final respecto a su contenido inicial, temperatura, pH, ºBrix y concentración de α-amilasa. Se determinó a partir de los gráficos de superficie de respuesta que, para una misma dosis de almidón inicial, las diferentes concentraciones de enzima no provocan una gran variación en la remoción de almidón, por lo que desde el punto de vista económico es favorable trabajar con una dosis de 0,01 %. A partir del estudio del proceso de hidrolisis enzimática en los jugos simulados, se determinó que la corriente más factible para la aplicación de la α-amilasa tanto técnica como económicamente es la meladura.
Palabras Claves: α-amilasa; hidrólisis enzimática; almidón; industria azucarera.
Abstract
The objective of the present investigation is to determine the current application of the enzymatic hydrolysis process with α-amylase in the production of raw sugar, for this an analysis and design of response surface experiments was developed. Under the study conditions, the enzyme proved to be effective in the splitting of starch with removal percentages between 83 and 99 %. A multiple linear regression model was fitted that explains 75,96 % of the variability of the final starch content with respect to its initial content, temperature, pH, ºBrix and α-amylase concentration. It is determined from the response surface graphs that, for the same initial starch dose, the different enzyme concentrations do not cause a large variation in starch removal, so from an economic point of view it is favorable work with a dose of 0,01 %. From the study of the enzymatic hydrolysis process in the simulated juices, it was determined that the most feasible stream for the application of α-amylase both technically and economically is honeydew.
Keywords: alpha amylase; enzymatic hydrolysis; starch; sugar industry.
Introducción
Dentro del sector industrial, la producción de azúcar crudo se considera uno de los procesos más importantes en el área de la industria alimentaria y el comercio, por los innumerables aportes que realiza a la economía. Uno de los parámetros que más afecta la calidad del mismo y del producto final es el contenido de polisacáridos, específicamente el almidón.
El almidón es un polisacárido que se incorpora al proceso por medio de la caña de azúcar que es la principal materia prima.1 Su presencia en el proceso de producción de azúcar crudo demora o inhibe la cristalización y aumenta las pérdidas de azúcar en la miel final, causa demoras en el proceso debido a viscosidades excesivas y pérdidas de sacarosa por modificaciones en el crecimiento del cristal,1,2 tiene la tendencia de ocluirse en el cristal de azúcar crudo.2-4 En el proceso de refinación reduce la filtración y la afinación y constituye un impedimento para el proceso de decoloración.3 De aquí la importancia de la cuantificación del mismo en la producción, en aras de la toma de medidas que reduzcan su contenido.
Atendiendo al efecto negativo que provoca el almidón en la calidad del azúcar crudo Zhou et al. propusieron para su eliminación la selección de variedades de caña sobre la base del contenido de almidón.4 La utilización de métodos físicos de separación como la ultrafiltración u ósmosis inversa, funcionan correctamente a pequeña escala, pero están lejos de ser desarrollados para su aplicación en procesos reales. Numerosos autores coinciden en que el tratamiento más eficaz para su eliminación consiste en adicionar la enzima α-amilasa para hidrolizar el almidón presente en el jugo.5,6 Las α-amilasas son enzimas extracelulares que catalizan la hidrólisis de los enlaces α-1,4-glicosídicos del almidón y libera diferentes tamaños de oligosacáridos en una configuración α-anomérica,7,8 contribuyen con casi una cuarta parte de las ventas totales anuales de enzimas en el mercado mundial.9-11
Bruijn y Jennings reportaron para una dosis de 7,2 ppm de amilasa bacteriana, porcentajes de remoción de almidón entre un 78 y 93 % en jugo mezclado en 15 min de hidrólisis;12 mientras que Cole et al. demostraron que para esta misma corriente un desdoblamiento eficiente puede ser logrado en 60 min con concentraciones de α-amilasa entre 0,5 y 500 ppm.13 Para una razón de 1-2,5 g de α-amilasa por tonelada de caña molida Penados, reportó una remoción de 30 a 50 % de almidón.2 Namer et al. para dosis de 2 a 5 g por tonelada de caña molida lograron más de 65 % de remoción en el tanque de jugo clarificado; también obtuvieron buenos resultados en la meladura para una razón de 5 g por tonelada de caña molida.14
En los últimos años la presencia de almidón en la industria azucarera cubana ha tomado relevancia para la comercialización del azúcar crudo, por lo que se han realizado varias investigaciones sobre el comportamiento del mismo en el proceso, sus efectos negativos y el proceso de hidrolisis enzimática como tecnología para su control.15-17 Como parte de estas investigaciones en los laboratorios del Centro de Estudios Biotecnológicos de la Universidad de Matanzas, se caracterizó una α-amilasa industrial, que presentó una actividad específica de 86 U/mg, además de altos porcentajes de actividad enzimática para valores de temperatura entre 35 y 90 ºC, y pH entre 5 y 8,16 características que permiten su aplicación en varias corrientes de la industria. Lo anterior sugiere la necesidad de cuantificar la efectividad del proceso de hidrólisis con la enzima caracterizada en dichas corrientes; para ello se parte de la hipótesis que si se realiza un diseño de experimentos para el estudio del efecto de la α-amilasa en la remoción de almidón en jugos simulados, será posible determinar bajo qué condiciones se favorece su acción. En función de lo anterior esta investigación tiene como objetivo determinar la corriente de aplicación de la enzima α-amilasa en el proceso de producción de azúcar crudo.
Este estudio es de carácter novedoso para la industria azucarera cubana, pues no existen evidencias de la aplicación de este tratamiento en el proceso de producción de azúcar crudo, de ahí la importancia que reviste determinar en qué momento o corriente del proceso es adecuado realizar el tratamiento, así como la dosis a emplear.
Materiales y métodos
La investigación se desarrolló en los laboratorios del Centro de Estudios Biotecnológicos de la Universidad de Matanzas. Entre los materiales que se emplearon en los experimentos se encuentran: α-amilasa industrial proveniente del Laboratorio Biológico Farmacéutico (LaBiofam) en Cienfuegos, almidón, ácido 3,5-dinitrosalisílico (DNSA), azúcar crudo proveniente del central azucarero “Mario Muñoz Monroy” en Matanzas, cloruro de calcio, yoduro de sodio, yodato de potasio, ácido clorhídrico, ácido acético, NaH2PO4*2H2O y NaHPO4.
Para el proceso investigativo se emplearon jugos simulados, con la finalidad de evitar las interferencias que pudieran tener las impurezas presentes en los jugos industriales que enmascaren el efecto de la enzima sobre el desdoblamiento de los almidones, y poder valorar la incidencia del pH, la temperatura y la concentración de sólidos solubles en el proceso de hidrolisis. Esto permitirá determinar la corriente más adecuada para realizar el tratamiento. Estudios posteriores, a partir de los resultados obtenidos, tendrán implícito corregir las dosis obtenidas a aplicar en jugos industriales.
Los jugos se simularon a escala de laboratorio con agua destilada y azúcar crudo para obtener la concentración de sólidos solubles necesarios expresados en ºBrix, el pH se ajustó utilizando como tampón acetato de sodio (1 mol/L, pH 5) y fosfato de sodio (1mol/L, pH 6,5 y 8). La molaridad final de los tampones en los jugos simulados fue de 100 mmol/L. El contenido de almidón se obtuvo añadiendo una solución al 2 % (2 g/100 mL) de almidón disuelto en agua destilada. Para lograr la concentración de almidón se tuvo en cuenta la concentración del mismo en la azúcar empleada (216,48 mg/kg) para la simulación de los jugos.
El estudio del efecto de la α-amilasa en la remoción de almidón en estos jugos se realizó mediante un diseño y análisis de experimentos, para determinar los factores experimentales (temperatura, pH, ºBrix, contenido de almidón, dosis de enzima) del proceso de hidrólisis enzimática que más inciden en el desdoblamiento de almidón; además de permitir encontrar las condiciones de los factores que garantizan valores óptimos en la respuesta. En la Tabla 1 se muestran los intervalos de los factores que se tuvieron en cuenta en el diseño de experimentos, valores que obedecen al rango normal de trabajo en el que se mueven las corrientes industriales donde es posible aplicar la enzima:
Tabla 1. Estudio de los parámetros para el diseño de los experimentos.
| Temperatura (ºC) | pH | ºBrix | Contenido de almidón inicial (mg/L) | Concentración de enzima (%) |
| 30 – 90 | 5-8 | 16-65 | 200-600 | 0,01-0,05 |
Para desarrollar el proceso de hidrólisis, se tomaron 50 mL del sustrato, y se adicionó la α- amilasa a diferentes concentraciones: 0,01 % (0,1 mg/mL), 0,03 % (0,3 mg/mL) y 0,05 % (0,5 mg/mL). Se incubó durante 30 minutos y se enfría a 4 ºC con el objetivo de detener la reacción de hidrólisis.13 A los jugos simulados y los hidrolizados obtenidos a partir de las condiciones del diseño de experimento se le determinó el contenido de almidón por la metodología propuesta por ICUMSA.19
Se realizó un diseño de experimentos de compuesto central para superficie de respuesta, tipo estrella, centrado en las caras, en el software Statgraphics Centurion 16.2. Para evaluar la calidad del modelo matemático se tuvieron en cuenta, para un nivel de confianza de 5 %, el coeficiente de determinación (R2), la prueba de Fisher de bondad de ajuste y el estadístico de Durbin Watson (DW). La influencia de los factores experimentales en el contenido de almidón final se determinó a partir del análisis de varianza ANOVA y el diagrama de Pareto correspondiente. Los gráficos de superficie de respuesta permiten observar la variación del contenido de almidón en tres corrientes de la industria, cuyas condiciones se determinan a partir de datos históricos de la misma (ver Tabla 2).
Tabla 2. Condiciones de las Corrientes a partir de datos históricos de la industria.
| Corrientes | Temperatura (ºC) | CV
(%) |
ºBrix | CV
(%) |
pH | CV
(%) |
| Jugo Alcalizado | 40 | 5,2 | 16 | 3,9 | 8 | 3,0 |
| Jugo Clarificado | 90 | 4,7 | 17 | 4,5 | 6,8 | 1,3 |
| Meladura | 65 | 5,0 | 63 | 5,0 | 6,8 | 0,2 |
Donde CV: coeficiente de variación de la muestra que se analiza.
Resultados y Discusión
Se realizó un diseño de experimento de compuesto central para superficie de respuesta mediante el software Statgraphics Centurion 16.2, con un total de 47 corridas experimentales, en función de las cuales se simulan los jugos, y se determinó el contenido de almidón a la muestra y su correspondiente hidrolizado. En la Figura 1 se muestra el comportamiento del contenido de almidón final (a) y el porcentaje de remoción por experimentos (b).
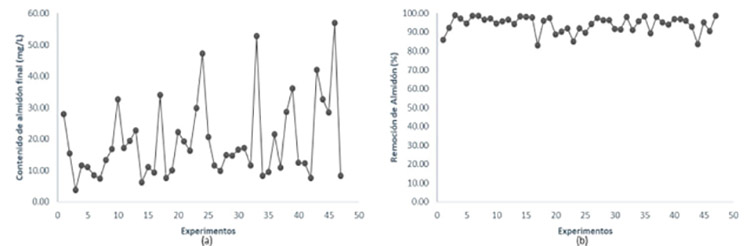
Figura 1. Proceso de hidrólisis del almidón: (a) Contenido de almidón final (mg/L) por experimentos; (b) Porcentaje de remoción de almidón por experimentos.
En la Figura 1a, se aprecia que el mayor valor de contenido de almidón corresponde al experimento 46 que se desarrolla a 30 ºC, 16 ºBrix, pH 8, dosis de enzima 0,01 % y 600 mg/L de almidón inicial, mientras que el menor valor de contenido de almidón corresponde al experimento 3 que ocurre a 60 ºC, 16 ºBrix, pH 6,5, dosis de enzima 0,03 % y 400 mg/mL de almidón inicial. En el experimento 3, las condiciones de hidrólisis fueron más favorables para la actividad de la enzima. La α-amilasa empleada en la investigación presenta su mayor actividad a pH 5 (pH óptimo) y retiene más de un 90 % de actividad a pH 6,5, en el intervalo de temperatura de 35 a 70 ºC muestra un porcentaje de actividad superior al 75 % y su máxima actividad catalítica a una temperatura de 60 ºC (temperatura óptima).16 Además, puede observarse que la dosis de enzima es menor en el experimento 46, para una mayor cantidad de sustrato.
En la Figura 1b, puede observarse que los valores de remoción de almidón varían entre un 83 y 99 % aproximadamente, el menor valor se alcanzó en el experimento 17 que se desarrolló a 30 ºC, 16 ºBrix, pH 5, una dosis de enzima de 0,01 % y 200 mg/L de almidón inicial, mientras que la mayor remoción ocurre bajo las condiciones del experimento 3.
En la Tabla 3 se muestran las condiciones a las que fueron realizados cada uno de los experimentos.
El estadígrafo R2 indica que el modelo, así ajustado, explica 75,96 % de la variabilidad en contenido de almidón final, encontrándose por encima del 70 %, valor sugerido como mínimo para fines de optimización.20 A través de la prueba de Fisher de bondad de ajuste se comprueba, por un estimador interno de la varianza del error experimental, que no existen evidencias de pérdida de la calidad de ajuste del modelo a partir de los errores experimentales, para una confianza del 95 % y que no se debe modificar o remover ningún término de este.
Al desarrollar el diseño de superficie de respuesta en el software Statgraphics Centurion 16.2, se obtiene el análisis de varianza ANOVA, el diagrama de Pareto, los gráficos de superficie de respuesta y el modelo matemático correspondiente al contenido de almidón final.
En la ecuación 1, se aprecia el modelo matemático que describe el efecto de la hidrólisis sobre el contenido de almidón.
Contenido Almidón Final =24,7999 – 1,67544*A + 0,456219*B + 6,05966*C + 334,884*C + 0,0493306*E + 0,0118597*AA – 0,0722879*BC – 0,000399037*BE -54,5672*CD – 0,566556*DE (1)
Donde A: temperatura (ºC); B: ºBrix; C: pH; D: concentración de α-amilasa (%); E: contenido de almidón inicial (mg/L).
Tabla 3. Concentración inicial y % de remoción de almidón en función de los parámetros estudiados en los experimentos.
| Exp. | Temperatura(ºC) | Concentración (ºBrix) | pH | Dosis de α-amilasa (%) | Almidón inicial (mg/L) | Remoción de almidón
(%) |
Exp. | temperatura (ºC) | Concentración (ºBrix) | pH | Dosis de α-amilasa (%) | Almidón inicial (mg/L) | Remoción de almidón
(%) |
| 1 | 30 | 16 | 8 | 0,05 | 200 | 86,03 | 25 | 30 | 65 | 5 | 0,01 | 200 | 89,66 |
| 2 | 90 | 65 | 5 | 0,01 | 200 | 92,31 | 26 | 90 | 16 | 8 | 0,05 | 200 | 94,20 |
| 3 | 60 | 16 | 6,5 | 0,03 | 400 | 99,03 | 27 | 60 | 40,5 | 6,5 | 0,01 | 400 | 97,53 |
| 4 | 60 | 40,5 | 6,5 | 0,03 | 400 | 97,08 | 28 | 60 | 40,5 | 6,5 | 0,03 | 400 | 96,28 |
| 5 | 60 | 40,5 | 6,5 | 0,03 | 200 | 94,50 | 29 | 60 | 40,5 | 6,5 | 0,03 | 400 | 96,31 |
| 6 | 90 | 16 | 8 | 0,05 | 600 | 98,58 | 30 | 30 | 16 | 5 | 0,05 | 200 | 91,72 |
| 7 | 90 | 65 | 5 | 0,05 | 600 | 98,76 | 31 | 90 | 16 | 5 | 0,01 | 200 | 91,40 |
| 8 | 60 | 40,5 | 8 | 0,03 | 400 | 96,65 | 32 | 60 | 40,5 | 6,5 | 0,03 | 600 | 98,05 |
| 9 | 90 | 16 | 5 | 0,01 | 600 | 97,19 | 33 | 90 | 16 | 8 | 0,01 | 600 | 91,19 |
| 10 | 30 | 65 | 8 | 0,01 | 600 | 94,55 | 34 | 90 | 65 | 5 | 0,05 | 200 | 95,88 |
| 11 | 60 | 65 | 6,5 | 0,03 | 400 | 95,70 | 35 | 90 | 16 | 5 | 0,05 | 600 | 98,43 |
| 12 | 90 | 65 | 8 | 0,01 | 600 | 96,75 | 36 | 30 | 65 | 8 | 0,05 | 200 | 89,29 |
| 13 | 30 | 40,5 | 6,5 | 0,03 | 400 | 94,34 | 37 | 90 | 65 | 8 | 0,05 | 600 | 98,17 |
| 14 | 90 | 40,5 | 6,5 | 0,03 | 400 | 98,45 | 38 | 30 | 16 | 5 | 0,05 | 600 | 95,22 |
| 15 | 90 | 65 | 5 | 0,01 | 600 | 98,15 | 39 | 30 | 65 | 5 | 0,01 | 600 | 93,99 |
| 16 | 60 | 40,5 | 5 | 0,03 | 400 | 97,68 | 40 | 60 | 40,5 | 6,5 | 0,03 | 400 | 96,88 |
| 17 | 30 | 16 | 5 | 0,01 | 200 | 83,03 | 41 | 60 | 40,5 | 6,5 | 0,05 | 400 | 96,91 |
| 18 | 90 | 65 | 8 | 0,01 | 200 | 96,15 | 42 | 90 | 65 | 8 | 0,05 | 200 | 96,15 |
| 19 | 60 | 40,5 | 6,5 | 0,03 | 400 | 97,51 | 43 | 30 | 16 | 5 | 0,01 | 600 | 93,00 |
| 20 | 90 | 16 | 8 | 0,01 | 200 | 88,92 | 44 | 30 | 16 | 8 | 0,01 | 200 | 83,65 |
| 21 | 30 | 65 | 5 | 0,05 | 200 | 90,36 | 45 | 30 | 65 | 5 | 0,05 | 600 | 95,26 |
| 22 | 90 | 16 | 5 | 0,05 | 200 | 91,87 | 46 | 30 | 16 | 8 | 0,01 | 600 | 90,52 |
| 23 | 30 | 65 | 8 | 0,01 | 200 | 85,04 | 47 | 30 | 65 | 8 | 0,05 | 600 | 98,63 |
| 24 | 30 | 16 | 8 | 0,05 | 600 | 92,12 | |||||||
El software Statgraphics utiliza para la validación de este modelo los parámetros que se muestran en la Tabla 4.
Tabla 4. Parámetros estadísticos para la validación del modelo matemático.
| Parámetros | Variable Respuesta |
| R2 (%) | 75,96 |
| Estadístico Durbin-Watson (P-value) | 2,19 (P=0,76) |
| F-Fischer (P-value) | 26.21 (P=0) |
En la Figura 2 se muestran los gráficos obtenidos en la validación del diseño de superficie de respuesta. No existen diferencias estadísticamente significativas entre los valores observados y predichos, como se observa en la Figura 2a, lo que supone una correcta descripción de la realidad experimental y del buen ajuste del modelo de superficie respuesta.
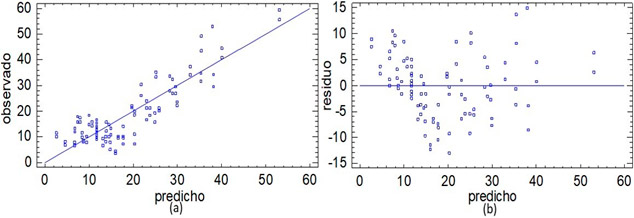
Figura 2. Validación del diseño de superficie de respuesta. (a) Valores de contenido de almidón final observados y predichos por el modelo; (b) Gráfico de residuos entre los valores de contenido de almidón final observados y del modelo ajustado.
El estadígrafo de Durbin-Watson (DW) es mayor que 0,05 para una confianza del 95 %, lo que permite inferir que los residuos no se encuentran correlacionados entre sí. Este análisis presenta gran importancia para evaluar la calidad del trabajo en la experimentación, puesto que señala que todos los factores que inciden sobre la variable respuesta se encuentran controlados o son considerados en la modelación experimental. Como el valor del estadígrafo es cercano a 2 puede decirse que los residuos varían aleatoriamente lo que se corrobora en la Figura 2b.
El análisis de varianza ANOVA que se muestra en la Tabla 5, permite evaluar si existe relación significativa entre los factores y la respuesta medida.
A partir de la Tabla 5, se puede apreciar que 10 efectos tienen un valor de probabilidad (p) menor que 0,05, indicando que son significativamente diferentes de cero con un nivel de confianza del 95 %, siendo los más significativos la temperatura, los ºBrix y la concentración de amilasa (p=0).
Tabla 5. Análisis de varianza para el contenido de almidón final.
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
| A:Temperatura | 3895,14 | 1 | 3895,14 | 90,39 | 0,0000 |
| B: ºBrix | 1225,8 | 1 | 1225,38 | 28,44 | 0,0000 |
| C:pH | 341,95 | 1 | 341,95 | 7,94 | 0,0061 |
| D:Conc Amilasa | 1651,72 | 1 | 1651,72 | 38,33 | 0,0000 |
| E:Cont Almidón Inicial | 711,45 | 1 | 711,45 | 16,51 | 0,0001 |
| AA | 2142,82 | 1 | 2142,82 | 49,73 | 0,0000 |
| BC | 451,67 | 1 | 451,67 | 10,48 | 0,0017 |
| BE | 244,68 | 1 | 244,68 | 5,68 | 0,0195 |
| CD | 171,50 | 1 | 171,50 | 3,98 | 0,0494 |
| DE | 328,68 | 1 | 328,68 | 7,63 | 0,0071 |
| Bloques | 2,57 | 1 | 2,57 | 0,06 | 0,8074 |
| Error total | 3533,43 | 82 | 43,09 | ||
| Total (corr.) | 14701,0 | 93 |
La influencia en la respuesta del sistema ante cambios en las condiciones puede ser observadas en el diagrama de Pareto (Figura 3). El mismo muestra cada uno de los efectos estimados de las variables y sus interacciones en orden decreciente de magnitud sobre el contenido de almidón final. La línea vertical permite determinar qué efectos son estadísticamente significativos.
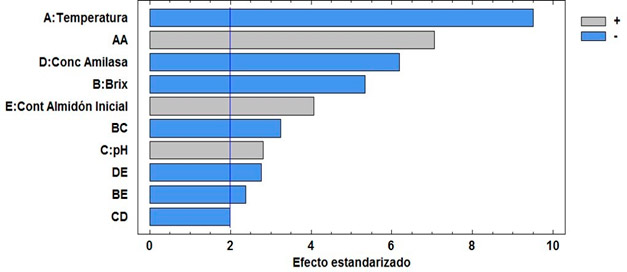
Figura 3. Efecto de los factores experimentales en el contenido de almidón (Diagrama de Pareto).
Como se observa en la Figura 3, la temperatura, la concentración de α-amilasa y el ºBrix tienen una influencia estadisticamente significativa y un efecto negativo sobre la respuesta, es decir a medida que aumentan, disminuye el contenido de almidón luego del proceso de hidrólisis. En cuanto al contenido de almidón inicial de la muestra y el pH, puede observarse en la figura que tienen una influencia significativa en la respuesta, pero en este caso un efecto positivo, a medida que aumentan se reduce la remoción de almidón.
Con el aumento de la temperatura aumenta la actividad catalítica de la enzima, lo que significa que se incrementa la capacidad de la misma de desdoblar el almidón, hasta alcanzar su máxima actividad a la temperatura óptima (60 ºC), para luego decrecer rápidamente debido al proceso de inactivación térmica que sufren las enzimas.21,22 Gonzalez determinó que la enzima se mantiene estable en un rango de temperatura entre 35-50 ºC, donde retiene más de un 90 % de su actividad, a temperaturas mayores de 60 ºC la actividad decrece significativamente; a 80 ºC la enzima perdió totalmente su actividad.16
Al aumentar la concentración de α-amilasa, se incrementa el grado de hidrolisis, pues se favorece la cantidad de sitios activos disponibles para la interacción enzima-sustrato, para una cantidad suficiente de almidón. A elevados niveles de ºBrix a altas temperaturas, la actividad de la enzima se preserva debido a la reducción de la velocidad de reacción, al reducirse la velocidad de difusión de la enzima.23
Al optimizar este modelo se obtiene que las condiciones que garantizan el mínimo contenido de almidón después del proceso de hidrólisis son las siguientes: 70,98 ºC, 65 ºBrix, pH 7,95, dosis de enzima de 0,05 % y contenido de almidón inicial de 581,28 mg/L. En el proceso de producción de azúcar crudo no existe una corriente específica que cumpla con estas condiciones de pH, ºBrix y temperatura. Esto motiva que no se tenga en cuenta este óptimo para la aplicación de la enzima.
En la Figura 4, se muestran los graficos de superficie de respuestas estimados para cada una de las corrientes.
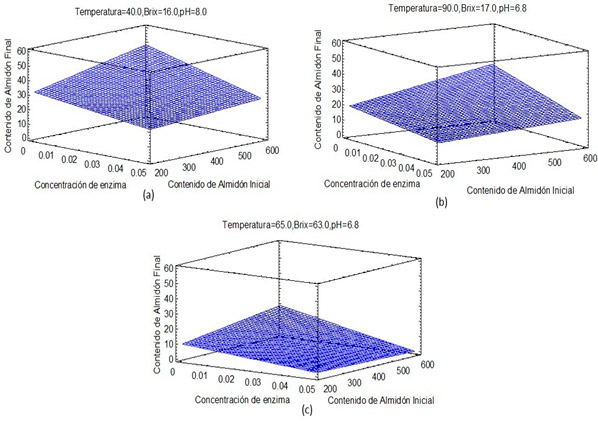
Figura 4. Superficie de respuesta estimada (a) Jugo Alcalizado; (b) Jugo Clarificado; (c) Meladura.
En la Figura 4, puede apreciarse de manera general que a medida que aumenta la dosis de enzima para un mismo contenido de almidón inicial, su contenido final se reduce, aunque no se observa una gran variación; mientras que para una misma dosis, al aumentar el contenido de almidón inicial, el contenido final del mismo es mayor, reafirmandose la influencia de los factores experimentales en la respuesta según el diagrama de Pareto. El contenido de almidón final varía entre 22 y 48 mg/L en el jugo alcalizado (Figura 4a), entre 12 y 35 mg/L en el jugo clarificado (Figura 4b) y entre 1 y 18 mg/L en la meladura (Figura 4c). La mayor remoción de almidón se alcanza en la meladura, los valores de temperatura y pH de la misma se encuentran cerca de los valores óptimos para la actividad de la enzima.16 Cole et al. obtuvieron que al aumentar los ºBrix de 15 a 60 se triplicaba la actividad de la enzima a altas temperaturas (96 ºC). 23
Para una misma corriente no existieron grandes diferencias entre la remoción a las distintas dosis de enzima aplicada, por lo que debe considerarse por criterios de costo de adquisición de la enzima emplear una dosis de 0,01 %. En la Tabla 6, se muestra el costo de aplicar la α-amilasa a esta dosis, en función de los flujos de las corrientes determinados a partir de datos históricos de la industria. Para este análisis se considera el costo unitario de la enzima de 15 $/kg.24
Tabla 6. Costo por concepto de enzima a aplicar en las corrientes objeto de estudio.
| Corrientes | Flujo (kg/t de caña molida) | Dosis de enzima a aplicar (kg/t de caña molida) | Costo de aplicación ($/año) |
| Jugo Alcalizado | 1440,91 | 0,136 | 1 480 787,02 |
| Jugo Clarificado | 1336,39 | 0,125 | 1 367 808,07 |
| Meladura | 324,58 | 0,024 | 269 794,14 |
| Tanto los flujos como las dosis de enzima se han expresado en función de la caña molida para permitir que los resultados sean extrapolables a otros procesos con diferente régimen de molienda | |||
En la Tabla 6, puede apreciarse que al ser el flujo de meladura a tratar inferior a las otras dos corrientes, el costo de aplicar la enzima en esta corriente es mucho menor. Si a este resultado se suma que los mejores porcentajes de remocion de almidon se lograron en esta misma corriente, se reafirma como la más adecuada para realizar el tratamiento enzimatico. Estudios realizados por Penados,2 Schoonees25 y Zhou et al.4 corroboran el uso de la α-amilasa en esta corriente, confirmando el lugar de su dosificación.
Conclusiones
Bajo las condiciones del estudio, la α-amilasa demostró ser efectiva en el desdoblamiento del almidón al alcanzarse porcentajes de remoción entre un 83 y 99 %. Los porcentajes de remoción alcanzados en los experimentos son superiores a los reportados por Bruijn y Jennings, 12 Cole et al., 13 Penados, 2 y Namer et al. 14 este resultado era de esperar, pues al ser simulados los jugos en el laboratorio no hay presencia de las impurezas propias de la industria azucarera. La corriente más factible para la aplicación de la α-amilasa tanto técnica como económicamente es la meladura. Sin embargo, estos criterios de selección no son suficientes, debido a que no se tienen en cuenta otros beneficios que provoca la hidrolisis enzimática, entre ellos se pueden mencionar: el aumento de la velocidad de sedimentación y la reducción del consumo de vapor.
Contribución de los autores: Conceptualización, Jesús Luis Orozco; Metodología, Héctor Luis Ramírez y Leissy Gómez Brizuela; software, Saul Dueñas Casas; validación, Saul Dueñas Casas; análisis, Jesús Luis Orozco y Saul Dueñas Casas; investigación, Saul Dueñas Casas, Héctor Luis Ramírez y Leissy Gómez Brizuela; recursos, Héctor Luis Ramírez y Leissy Gómez Brizuela; redacción, Saul Dueñas Casa; revisión y edición, Jesús Luis Orozco, Héctor Luis Ramírez y Leissy Gómez Brizuela.
Financiamiento: Esta investigación fue financiada por el proyecto “Aplicación de la enzima α-amilasa libre e inmovilizada en la producción de azúcar crudo” (PT211MT001-011), perteneciente al programa: Seguridad Alimentaria. Producción, Calidad y Sostenibilidad (01), del Ministerio de Ciencia Tecnología y Medio Ambiente (CITMA) de la provincia de Matanzas, Cuba.
Declaración del buró de revisión institucional: No aplicable.
Declaración del informe de consentimiento: No aplicable.
Acknowledgments: Los autores le agradecen al Ministerio de Ciencia Tecnología y Medio Ambiente (CITMA) y a la Asociación de Técnicos Azucareros de Cuba (ATAC), por el apoyo provisto en el desarrollo de esta investigación.
Conflicto de intereses: Los autores expresan que no hay conflicto de intereses.
Referencias
- Castro, N. P. Determinación de la concentración de almidón por caracterización espectrofotométrica en el jugo de caña de azúcar de las variedades: Cp72-2086, Cp88-1165 y Cp73-1547 utilizadas en el ingenio trinidad Guatemala. Tesis en opción al título de Ingeniero Químico, Universidad de San Carlos de Guatemala, Guatemala, febrero 2015.
- Penados, M. Evaluación del impacto de adicionar la enzima alfa amilasa durante el proceso de evaporación en los niveles de almidón de azúcar crudo producido en un ingenio azucarero. Tesis en opción al título de Ingeniero Químico, Universidad de San Carlos de Guatemala, Guatemala, febrero 2004.
- Eggleston, G.; Viator, R.; Grisham, M. Glyophosphateripener effects on the processing quality of different sugarcane tissues. ISSCT Congress South Africa 2007, 26, 1460-1467.
- Zhou, M.; Kimbeng, C.; Eggleston, G.; Viator, R.; Hale, A.; Gravois, K. Issues of starch in sugar cane processing and prospects of breeding for low starch content in sugar cane. Sugar Cane International 2008, 26, 3-17.
- BeMiller, J.N.; Whistler, R.L. Starch: Chemistry and Technology, 3rd ed.; Academic Press: Purdue University, USA, 2009; pp. 629-655.
- Patil, P.P.; Shinde, S.S.; Shaikh, T.I.; Trivedi, M.M. Properties of alpha-amylases & its industrial importance. World Journal of Pharmaceutical Research 2022, 11, 351-359.
- Farooq, M.A.; Ali, S.; Hassan, A.; Tahir, H.M.; Mumtaz, S.; Mumtaz, S. Biosynthesis and industrial applications of α‑amylase: a review. Archives of Microbiology 2021, 203, 1281–1292. https://doi.org/10.1007/s00203-020-02128-y.
- Savaner, S.; Sohani, S. Review on microbial α-amylase, types & their industrial application. UGC Care Group-1 Journal 2020, 23, No.04 (III).
- Balakrishnan, D.; Kumar, S.S.; Sugathan, S., 2019. Enzymes in Industrial Food Processing in Green Bio-processes, 1st; Parameswaran, B., Varjani, S., Raveendran, S., Eds.; Springer, Singapore, 199 – 227. https://doi.org/10.1007/978-981-13-3263-0
- Masina, N.; et al. A review of the chemical modification techniques of starch. Polym. 2017, 157, 1226-1236. https://doi.org/10.1016/j.carbpol.2016.09.094.
- Sindhu, R.; Binod, P.; Madhavan, A.; Beevi, U.S.; Mathew, A.K.; Abraham, A.; Pandey, A.; Kumar, V. Molecular improvements in microbial a -amylases for enhanced stability and catalytic efficiency. Technol. 2017, 245, 1740-1748. https://doi.org/10.1016/j.biortech.2017.09.084.
- Bruijn, J.; Jennings, R.P. Enzymatic hydrolysis of starch in cane juice. Proceedings of The South African Sugar Technologists Association 1968, pp. 45-52.
- Cole, M.R.; Eggleston, G.; Gilbert, A.; Chung, Y.J. Development of an Analytical Method to Measure Insoluble and Soluble Starch in Sugarcane and Sweet Sorghum Products. Food Chemistry 2016, 190, 50–59. https://doi.org/10.1016/j.foodchem.2015.05.049.
- Namer, I., Rosa Pérez, J., Dávila, H., y Rivas, E. Caracterización de la producción y aplicación de enzimas en la industria azucarera cubana (1ra. Parte). ICIDCA 1988.
- Alonso La Rosa, I. Influencia del contenido de almidón durante el proceso de producción de azúcar crudo. Tesis en opción al título de Ingeniero Químico, Universidad de Matanzas, Cuba, julio 2017.
- González, L. Estudio de las propiedades funcionales y operacionales de la α-amilasa inmovilizada en el proceso desdoblamiento de almidón. Tesis en opción al título de Ingeniero Químico, Universidad de Matanzas, Cuba, julio 2018.
- León Alonso, P. Estudio de las propiedades funcionales y operacionales de la α-amilasa inmovilizada en el proceso de desdoblamiento de almidón. Tesis en opción al título de Ingeniero Químico, Universidad de Matanzas, Cuba, julio 2018.
- Fadilah, R.; Syamsiah, H. Hydrolysis of starch in porang flour using alpha amylase. Journal of Engineering Science and Technology 2015, 6, 1-8.
- The determination of starch in raw sugar by a modified BSES method – Official. Berlin, Germany: Bartens, 2013.
- Gutiérrez, H.; de la Vara Salazar R. Análisis y diseño de experimentos, 3rd ed.; McGRAW-HILL/INTERAMERICANA EDITORES, México, 2008.
- Shukla, R.J.; Singh, S.P. Structural and catalytic properties of immobilized α-amylase from Laceyella sacchari TSI-2. International Journal of Biological Macromolecules 2016, 85, 208–216. https://doi.org/10.1016/j.ijbiomac.2015.12.079.
- Kuddus, M. Introduction to Food Enzymes. In Enzymes in Food Biotechnology (Chapter 1). Academic Press, University of Hail, Saudi Arabia, 2019.
- Cole, M.R.; Rose, I.; Chung, Y.J.; Eggleston, G. A structured approach to target starch solubilisation and hydrolysis for the sugarcane industry. Food Chemistry 2015, 166, 165- 172. https://doi.org/10.1016/j.foodchem.2014.05.151.
- Disponible en: https://www.alibaba.com/showroom/moto-bike.html?cps=v45jhkki&bm=cps&src=saf&msclkid=464e6011b7b61de3e89e069e4ed8d7f5 (Acceso el 10 de septiembre del 2019).
- Schoonees, B.M. Starch hydrolysis using α-amylase: A laboratory evaluation using response surface methodology. Proceedings of The South African Sugar Technologists Association 2004, 78, 427-439.
| Received: 20 June 2024 | Accepted: 30 August 2024 | Published: 15 September 2024 |
Citation: Dueñas-Casas, S., Ramírez, L., Gómez-Brizuela, L., Orozco, L. Hidrólisis enzimática de almidón con α-amilasa en la industria azucarera. Bionatura. 2024; Volume (9). No 3.
Peer review information: Bionatura thanks the anonymous reviewers for their contribution to the peer review of this work using https://reviewerlocator.webofscience.com/
All articles published by Bionatura Journal are freely and permanently accessible online immediately after publication, without subscription charges or registration barriers.
Publisher’s Note: Bionatura stays neutral concerning jurisdictional claims in published maps and institutional affiliations.
Copyright: © 2024 by the authors. Submitted for possible open access publication under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/)



















