Vol 8 No 4 2023 – 35
Formulación y caracterización de una crema de anfotericina B y aceite esencial de Burseragraveolens para el tratamiento local de la candidiasis cutánea
Formulation and characterization of an amphotericin B cream and Bursera graveolens essential oil for the local treatment of cutaneous candidiasis
Lupe Carolina Espinoza 1,* , Oscar Correa 1 , Lilian Sosa 2,3, Natalia Días-Garrido 4, Santiago Ojeda 1, Eduardo Valarezo 1, Luis Cartuche 1, Thalía Bravo 1 y Paulo C. Granda 1,5.
1 Departamento de Química, Laboratorio de Tecnología Farmacéutica y Productos Naturales, Universidad Técnica Particular de Loja, Loja 110150, Ecuador.
2 Instituto de Investigaciones en Microbiologia (IIM), Universidad Nacional Autonóma de Honduras (UNAH), Tegucigalpa, Honduras.
3 Instituto de Investigación de Ciencias Aplicadas y Tecnológicas (IICAT), Universidad Nacional Autonóma de Honduras (UNAH), Tegucigalpa, Honduras.
4 Department of Biochemistry and Physiology, Faculty of Pharmacy and Food Sciences, University of Barcelona, 08028 Barcelona, Spain.
5 Department of Pharmacy, Pharmaceutical Technology and Physical Chemistry, Faculty of Pharmacy and Food Sciences, University of Barcelona, 08028, Barcelona, Spain.
*Corresponding author: lcespinoza@utpl.edu.ec
Available from. http://dx.doi.org/10.21931/RB/2023.08.04.36
RESUMEN
La candidiasis cutánea es una micosis producida principalmente por la proliferación de Candida albicans.La anfotericina B es un fármaco altamente eficaz que se administra por vía intravenosa para tratar esta enfermedad infecciosa. Los tratamientos locales con este fármaco están limitados por el elevado peso molecular y alta hidrofobicidad que limitan su paso a través de la piel. Objetivo. El propósito de este estudio fue diseñar y caracterizar una crema tópica de anfotericina B enriquecida con aceite esencial de Bursera graveolens (denominado tambien aceite de palo santo) para promover la permeación de este fármaco. La formulación fue elaborada utilizando excipientes farmacéuticamente aceptados para su uso tópico. Se evaluaron diferentes parámetros físicos y químicos como: pH, comportamiento reológico, extensibilidad, contenido de fármaco y estabilidad. Los estudios de permeación ex vivo fueron realizados utilizando piel humana y celdas de difusión de Franz. La actividad antimicrobiana in vitro de la crema fue evaluada mediante determinación de la Concentración Mínima Inhibitoria (CMI) contra cepas de C. albicans y su citotoxicidad fue analizada utilizando la línea celular de queratinocitos humanos HaCaT. Resultados. La formulación presentó características apropiadas para su administración tópica incluyendo un pH de 5.6, una viscosidad de 854.0±30.21 mPa·s con comportamiento pseudoplástico, una adecuada extensibilidad, así como alta estabilidad y baja citotoxicidad. La incorporación del aceite esencial de B. graveolens mejoró la difusión del fármaco a través del estrato córneo (675.98 µg/g/cm2) y aumentó la eficacia contra el patógeno aproximadamente 4 veces con respecto a una formulación de anfotericina B sin el aceite esencial. Conclusión. La crema de anfotericina B formulada en este estudio presenta resultados prometedores para infecciones causadas por C. albicans desde el punto de vista fisicoquimico y microbiológico, estudios en humanos se recomiendas para evaluar su actividad in vivo.
Palabras clave: candidiasis, anfotericina B, aceite esencial, Bursera graveolens.
ABSTRACT
Cutaneous candidiasis is a mycosis caused mainly by the proliferation of Candida albicans. Amphotericin B is a highly effective intravenously drug to treat this infectious disease. Local treatments with this drug are limited by the high molecular weight and high hydrophobicity that limit its passage through the skin. Aim. This study aimed to design and characterize a topical amphotericin B cream enriched with Bursera graveolens essential oil (also known as palo santo oil) to promote the permeation of this drug. The formulation was prepared using pharmaceutically accepted excipients for topical use. Physical and chemical parameters, such as pH, rheological behavior, extensibility, drug content, and stability, were evaluated. Ex vivo permeation studies were performed using human skin and Franz diffusion cells. The in vitro antimicrobial activity of the cream was evaluated by determining the Minimum Inhibitory Concentration (MIC) against C. albicans strains, and its cytotoxicity was analyzed using the HaCaT human keratinocyte cell line. Results. The formulation presented appropriate characteristics for topical administration, including a pH of 5.6, a viscosity of 854.00 ± 30.21 mPa·s with pseudoplastic behavior, adequate extensibility, high stability and low cytotoxicity. Incorporating the essential oil of B. graveolens improved the diffusion of the drug through the stratum corneum (675.98 µg/g/cm2). It increased the efficacy against the pathogen approximately 4 times compared to an amphotericin B formulation without the essential oil. Conclusion. The amphotericin B cream formulated in this study presents promising results for infections caused by C. albicans from a physicochemical and microbiological point of view; studies in humans are recommended to evaluate its in vivo activity.
Keywords: candidiasis, amphotericin B, essential oil, Bursera graveolens.
INTRODUCCIÓN
En la actualidad los casos de micosis cutáneas tienen una gran importancia clínica debido al continuo aumento de pacientes y la resistencia a los fármacos convencionales1. La candidiasis cutánea destaca como una de las micosis superficiales de mayor frecuencia, la cual es producida por la proliferación en la piel de organismos fúngicos del tipo Candida spp., principalmente C. albicans2, 3. La infección por este hongo produce irritación en la piel, enrojecimiento y la formación de edemas acompañados de prurito intenso4.
Los tratamientos empleados contra C. albicans consisten en el uso de azoles y polienos, entre ellos clotrimazol, miconazol, fluconazol, itraconazol y nistatina. Sin embargo, el uso constante e inadecuado de estos medicamentos ha provocado que C. albicans desarrolle mecanismos de resistencia a ellos5, 6. Frente a esto, se han empleado fármacos con mayor umbral terapéutico como la anfotericina B, un fármaco altamente eficaz para tratar diversas patologías relacionadas con hongos. El mecanismo de acción de este fármaco consiste en unirse al ergosterol presente en la membrana celular del agente fúngico, creando canales que inducen pérdida de protones y cationes monovalentes y, en consecuencia, despolarización y muerte celular7. No obstante, su uso se ve limitado ya que debido a su administración intravenosa provoca un efecto sistémico causando efectos adversos graves como la hepatotoxicidad y nefrotoxicidad8, 9.
Una formulación tópica de anfotericina B podría ser usado como estrategia para provocar un efecto local en la piel y reducir los efectos sistémicos del fármaco. Sin embargo, la Anfotericina B tiene un elevado peso molecular (926.07 Da) y una pobre solubilidad lo que dificulta su permeación a través del estrato córneo y su distribución en la epidermis y la dermis, siendo necesario la incorporación de excipientes con propiedades potenciadoras de la permeabilidad, los cuales idealmente deberían inducir una reducción temporal y reversible de la función de barrera del estrato córneo para facilitar la permeación del fármaco a través de la piel 8, 10, 11.
Los aceites esenciales han sido objeto de interés dentro de la industria farmacéutica debido a sus propiedades como promotores en la permeación de fármacos, así como sus actividades antibacterianas, antifúngicas, antioxidantes y antiinflamatorias12, 13. Como promotores de la permeación, los aceites esenciales aumentan la difusión del fármaco mediante cambios en la estructura del estrato córneo y la interacción con los lípidos intercelulares, esta propiedad facilita el transporte de moléculas por las diferentes capas de la piel siendo útil para mejorar la biodisponibilidad de algunos fármacos14, 15.
En particular, el aceite esencial obtenido a partir del fruto de Bursera graveolens compuesto principalmente de limoneno (49,89%), α-felandreno (37,64%) y mentofurano (6,08%), es un metabolito secundario volátil de interés ya que su composición química rica en terpenos le confiere al aceite una posible acción potenciadora de la permeación de fármacos16, 17. Adicionalmente, varios estudios han reportado importantes actividades terapéuticas del aceite esencial de B. graveolens incluyendo su potencial antioxidante, antifúngico y anticancerígeno18.
Con estos antecedentes, el propósito de este estudio fue diseñar y caracterizar una crema tópica de anfotericina B y aceite esencial de B. graveolens como alternativa para el tratamiento local de la candidiasis cutánea.
MATERIALES Y MÉTODOS
La anfotericina B fue obtenida de la empresa Acofarma (Barcelona, España). El Dimetilsulfoxido (DMSO) fue obtenido de la empresa Alfa Aesar (Massachusetts, Estados Unidos). El aceite de B. graveolens fue donado del Laboratorio de Operaciones Unitarias de la Universidad Técnica Particular de Loja17. El Propilenglicol fue adquirida de Sigma-Aldrich (San Luis, Misuri, Estados Unidos). El alcohol cetoestearílico, Petrolato líquido, Alcohol cetílico, Tween 80, Ácido cítrico y Benzoato de sodio se obtuvieron de Fagron Ibérica (Barcelona, España). Todos los compuestos químicos y reactivos fueron de grado analítico.
Cuantificación por Cromatografía Líquida de Alta Resolución (HPLC)
La valoración de la anfotericina B se realizó usando un cromatógrafo líquido de alta resolución (HPLC, por sus siglas en inglés) Thermo Scientific™ UltiMate™ 3000 acoplado a espectrometría de masas amaZon speed – Bruker Daltonics. El método cromatográfico se llevó a cabo utilizando una columna Kromasil C18 (250×4.4 mm, 5µm) y una fase móvil de acetonitrilo y ácido acético glacial al 3,75% (65:35, v/v), la cual fue bombeada a un caudal de 0.5 mL/min. Se inyectó un volumen de 10 µL y se analizó el eluido a una longitud de onda UV de 407 nm.
Desarrollo de la crema tópica de anfotericina B y aceite esencial de B. graveolens
Para la preparación de la crema tópica, la anfotericina B fue disuelta en DMSO, se incorporó el propilenglicol y finalmente el aceite de B. graveolens mediante agitación constante. El alcohol cetoestearílico, alcohol cetílico y petrolato líquido fueron fundidos a 55 ºC. A la vez, el benzoato de sodio y ácido cítrico fueron disueltos a la misma temperatura en agua destilada. Posteriormente, se mezclaron los aceites fundidos con la fase acuosa y el tween 80 durante 3 minutos utilizando un agitador Ultraturrax IKA T50 a 1500 rpm. Finalmente, se incorporó la mezcla de anfotericina B, propilenglicol y aceite de B. graveolens agitando durante 2 minutos.
Caracterización física y química
Se realizó un control organoléptico analizando el color, olor y apariencia del producto desarrollado. Asi mismo, se llevó a cabo un control de calidad físico químico que incluyó análisis de pH, comportamiento reológico, viscosidad y contenido de fármaco. El pH de la crema se determinó utilizando un pH metro GLP 22.
Las mediciones reológicas y de viscosidad de la crema de anfotericina B y aceite de B. graveolans se realizaron con un reómetro rotacional Thermo Scientific Haake Rheostress 1 (Thermo Fisher Scientific, Kalsruhe, Alemania) equipado con un sistema sensor de placa cónica que incluye una placa inferior fija y un cono superior móvil Haake C60 / 2Ti. (60 mm de diámetro, 2º ángulo, 0,105 mm de separación). Después de 24 h de preparación de la crema, se realizó el experimento por duplicado, en el cual la muestra fue sometida a un programa de perfil de corte de 3 pasos: un periodo de aceleración (0 a 50 s-1) durante 3 min, período de velocidad de cizallamiento constante a 50 s-1 durante 1 min y un periodo de desaceleración (50 a 0 s-1) durante 3 min.
La determinación de la alteración de la microestructura durante la prueba o «tixotropía aparente» (Pa/s) se evaluó mediante la determinación del área del bucle de histéresis. Luego, los datos obtenidos de las curvas de flujo se ajustaron a diferentes modelos matemáticos: Newton, Bingham, Ostwald-de-Waele, Cross, Casson y Herschel-Bulkley y se seleccionó el mejor ajuste según el valor del coeficiente de correlación (r)19.
La extensibilidad de la formulación se analizó utilizando 1 g de muestra, la cual fue colocada en el centro de la placa base de un extensómetro (Departamento de Farmacia y Tecnologia Farmaceutica y Fisicoquímica). Posteriormente, se colocó una placa de vidrio (7,93 g) sobre la muestra sin deslizar y se añadieron una serie de pesos (7.93, 27.89, 57.82, 107.69, 157.55, 207.46, 237.50 y 307.69 g) a intervalos de 1 min. El área extendida de la muestra se registró y luego se ajustó a modelos matemáticos utilizando GraphPad Prism® versión 6.0.
El contenido de fármaco en la crema se determinó disolviendo 100 mg de formulación en 5 mL de DMSO: metanol (1:1, v/v). Después de someter a baño de ultrasonido durante 1 min, la solución se filtró y se analizó mediante el método de HPLC descrito anteriormente.
Estudios de estabilidad física y química
Para los estudios de estabilidad, se almacenaron muestras de crema en envases de vidrio ámbar de 100 mL de capacidad en condiciones preestablecidas de temperatura y humedad relativa (HR): 30±2 °C / 65±5% HR y 25±2 °C / 60±5% HR durante 3 meses. La caracterización física y química de la formulación se realizó antes y después del almacenamiento en las condiciones mencionadas de acuerdo con los métodos descritos en el apartado previo. El contendio de crema en los envases de vidrio ambar fue de aproximadamente de 90 mL.
Estudios de permeación ex vivo
Para los estudios de permeación, se probó la crema formulada a base de anfotericina B y aceite esencial de B. graveolens y adicionalmente, se desarrolló una segunda crema utilizando la misma fórmula cuali-cuantitativa, pero sin la incorporación del aceite esencial, con el fin de evaluar el papel de este aceite en la permeación de fármacos. Estos ensayos se realizaron en celdas de difusión de Franz de 6 mL con área de difusión de 0,64 cm2 utilizando Transcutol P como medio receptor, el cual fue mantenido en constante agitación durante todo el experimento. Muestras de piel humana fueron usadas como membranas para la permeación, las mismas que fueron obtenidas durante una lipectomía abdominal de una mujer sana de 38 años, quien otorgó su consentimiento informado por escrito de acuerdo con el Comité Ético (número 001, de 20 de enero de 2016). Las muestras de piel cortadas a 0.4 mm de espesor fueron montadas entre el compartimento donante y receptor y se ajustó la temperatura de ensayo a 32±0.5 °C. Se colocó una muestra de 200 mg de cada formulación en el compartimento donante en contacto con la superficie exterior de la piel y a intervalos prestablecidos de tiempo se recogieron alícuotas de 300 µL del compartimento receptor y reemplazándose con el mismo volumen de medio receptor fresco. Estas alícuotas se analizaron por HPLC utilizando la metodología previamente descrita. Al final del experimento, se retiraron las muestras de piel de las celdas de difusión de Franz, se lavaron con agua destilada y se cortaron en sus bordes para retener solo el área de permeación. Luego, las muestras de piel se pesaron y se sumergieron en 1 mL de DMSO durante 30 min bajo sonicación fría para extraer el fármaco retenido en la piel (Qret, µg fármaco/g tejido/cm2). Finalmente, la solución resultante se filtró y analizó por HPLC.
Estudios de citotoxicidad
Se realizó un ensayo de citotoxicidad de MTT in vitro usando la línea celular de queratinocitos humanos HaCaT. Las células se ajustaron a 2 × 105 células/mL, se sembraron en una placa de 96 pocillos durante 24 h en medio Eagle modificado de Dubelcco (DMEM) con alto contenido de glucosa tamponado con HEPES 25mM y se suplementaron con 1% de aminoácidos no esenciales: 100 U/mL de penicilina, 100 g/mL de estreptomicina y suero fetal bovino inactivado por calor al 10%. Luego, las células se incubaron con diferentes diluciones (1/500 a 1/2000 durante 24 h) de crema formulada a base de anfotericina B y aceite esencial de B. graveolens. Posteriormente, las células HaCaT se lavaron con PBS estéril al 1% y se incubaron con solución de MTT (Sigma-Aldrich Chemical Co, St. Louis, MO, EE. UU.) (2.5 mg/mL) durante 2h a 37°C. A continuación, se eliminó cuidadosamente el medio y se añadieron 0.1 mL de reactivo de solubilización (Dimetilsulfóxido al 99%) para lisar las células y disolver los cristales de MTT de color púrpura. La viabilidad celular se midió a 570 nm en un fotómetro de microplaca Varioskan TM LUX (Thermo Scientific, Waltham, MS, EE. UU.). Paralelamente, se procesó un control negativo (células sin estimulación ni tratamiento) para su comparación. Los resultados se expresaron como porcentaje de supervivencia celular en relación con el control (células HaCaT no tratadas, viabilidad del 100%) usando la siguiente ecuación:
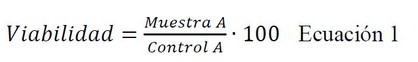
Estudios de eficacia microbiológica in vitro
Para la determinación de la Concentración mínima inhibitoria (CMI) se realizó un estudio de micro dilución en caldo con la técnica doble seriada según el procedimiento de EUCAST usando esporas de C. albicans ATCC 10231. Estas cepas fueron incubadas para su reactivación mediante la técnica Overnight 18 horas antes del ensayo. Seguidamente se tomaron 10 mL del caldo Saboround de la empresa BD con 10 µL de la cepa Overnight con el fin de llegar a una concentración de 1.5x según la escala de McFarland.
Por otro lado, se preparó una solución de la crema disolviendo sobre 80 µL de DMSO 1 mg de la crema preparada con una concentración inicial de 1 µg/mL. Se probaron la crema formulada a base de anfotericina B y aceite esencial de B. graveolens y una crema de anfotericina B con la misma fórmula cuali-cuantitativa, pero sin la incorporación del aceite esencial.
En una microplaca estéril de 96 pocillos se dispensó 180 µL de caldo Saboraund, y 20 µL de solución de crema, siendo la primera dilución de la cual se resuspendió y se tomó 100 µL y se dispensó en el siguiente pocillo, repitiendo este procedimiento hasta obtener las concentraciones seriadas desde 1 µg/mL hasta 0.015625 µg/mL. Finalmente se añadió 100 µL de la cepa preparada (1.5x). Se incubó a 37 ºC por 24 horas en una incubadora INB 500.
RESULTADOS Y DISCUSIÓN
Formulación y caracterización de la crema de anfotericina B y aceite esencial de B. graveolens
La fórmula de composición del producto desarrollado se detalla en la Tabla 1. La formulación presentó un color durazno, olor cítrico maderero intenso y una apariencia totalmente homogénea, libre de grumos y precipitados, evidenciando una buena afinidad entre los excipientes20.
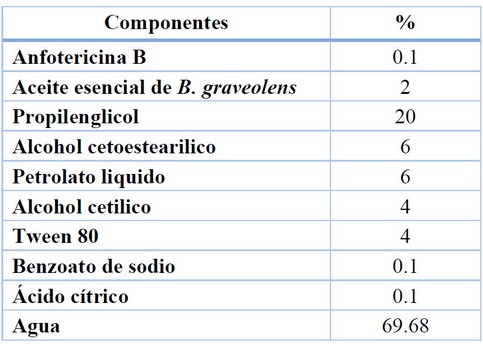
Tabla 1. Composición de la crema de anfotericina B y aceite esencial de B. graveolens.
El pH de la crema fue ligeramente ácido (5.6) mostrando un pH eudérmico, lo que indica que sería ideal para su aplicación tópica debido a la biocompatibilidad con la acidez natural de la piel asegurando efectos no irritantes 21. El contenido de fármaco evaluado mediante HPLC mostró un valor de 99.1±0,06% al día siguiente de la fabricación del producto.
La viscosidad y el comportamiento reológico de una formulación influyen en parámetros biofarmacéuticos como las velocidades y cantidades de liberación de fármacos a partir de sus vehículos y proporcionan información sobre las características sensoriales, la capacidad de esparcimiento y el comportamiento de llenado/dosificación de la fórmula 22. En este estudio, se determinó que la crema de anfotericina B y aceite esencial de B. graveolens presenta un comportamiento reológico pseudoplástico (modelo Cross r2=0.9997) con una viscosidad media a 50 s-1 de 854.0±30.21 mPa·s. Asimismo, se encontró una tixotropía aparente de 958,3 Pa/s (bucle de hysteresis) (Figura 1). El comportamiento tixotrópico favorece la aplicación tópica, ya que en este tipo de reología la viscosidad de la formulación varía con el rozamiento e induce una mejor retención sobre la piel lo que genera ventajas especialmente en aquellos casos donde deseamos que el efecto sea local 23.
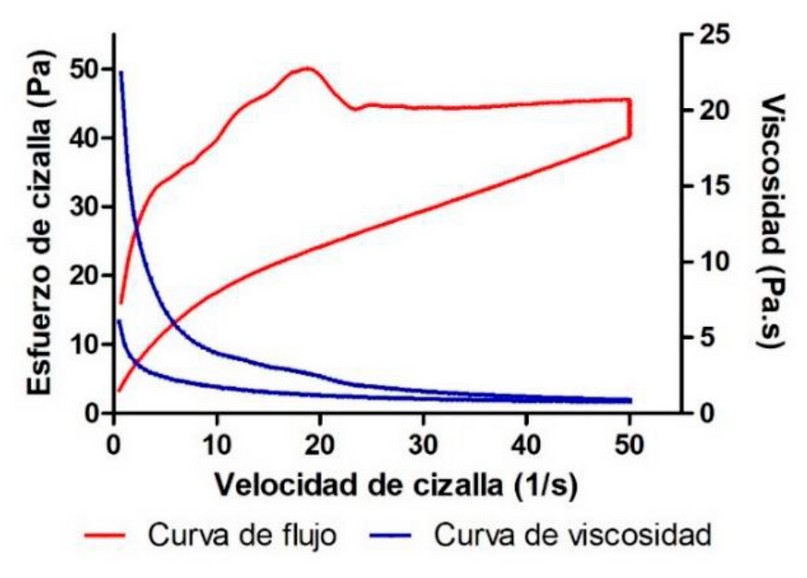
Figura 1. Comportamiento reológico de la crema de anfotericina B y aceite esencial de B. graveolens
Los valores de extensibilidad a 25 °C aumentaron proporcionalmente con el peso adicionado hasta alcanzar una extensibilidad máxima de 17.21 cm2 siguiendo un modelo matemático de asociación de una fase (Figura 2). Este resultado indica características óptimas y adecuadas para la manipulación, distribución y absorción de la crema en el sitio de aplicación, siendo agradable al tacto y cómodo para su uso en los pacientes24, 25.
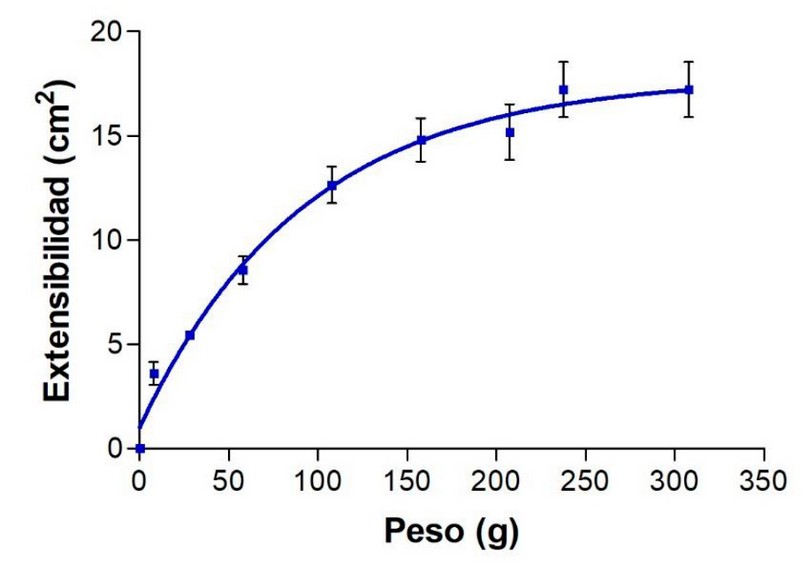
Figura 2. Perfil de extensibilidad de la crema de anfotericina B y aceite esencial de B. graveolens.
Estudios de estabilidad física y química
Durante los estudios de estabilidad llevados a cabo durante 3 meses a 25 y 30 °C, la formulación no mostró cambios en los aspectos organolépticos como color, olor y apariencia, lo que sugiere ausencia de posibles interacciones químicas que alteren las cualidades de la crema. Estos resultados fueron corroborados con los análisis a nivel físico y químico (Tabla 2), los cuales confirmaron que parámetros como el pH y viscosidad se mantienen sin cambios significativos en las diferentes condiciones de almacenamiento, mostrando valores adecuados para su uso dérmico24, 26, 27.
El contenido de fármaco dentro de la crema se mantuvo estable durante los 3 meses de estudio, únicamente se observó una disminución de 0.1 y 0.6% de fármaco en las muestras almacenadas a 25 y 30 °C, respectivamente. Este resultado sugiere una alta compatibilidad entre el fármaco y los excipientes utilizados, confiriendo a la formulación final una estabilidad química aceptable y en consecuencia se garantiza la eficacia del fármaco. Sin embargo, estudios adicionales de estabilidad a largo plazo son requeridos para confirmar estos hallazgos y dar cumplimiento a las normas internacionales28.
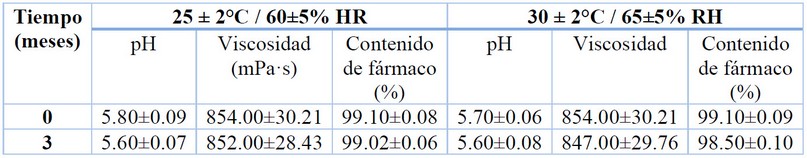
Tabla 2. Estabilidad fisicoquímica de la crema de anfotericina B y aceite esencial de B. graveolens
Estudios de permeación ex vivo
La eficacia de un producto administrado tópicamente depende de la capacidad del fármaco para atravesar el estrato córneo y así alcanzar una concentración efectiva en el sitio acción 29, 30. El gran peso molecular (926.07 Da) y la alta hidrofobicidad de la anfotericina B podría limitar su paso a través de la piel, por ello el uso de estrategias de formulación como la adición de promotores de permeación podrían ser útiles para sobrellevar estas desventajas 31. En este estudio, la permeación ex vivo se realizó con la crema formulada a base de anfotericina B más aceite esencial de B. graveolens y una crema de anfotericina B en ausencia de este aceite con el objetivo de evaluar el rol del aceite esencial en la permeación del fármaco. Los resultados mostraron que no se detectó anfotericina B en el compartimento receptor en ninguna de las dos formulaciones durante un período de 24 h de ensayo. Este mismo comportamiento se ha observado en otros estudios donde no hubo permeación del fármaco en formulaciones elaboradas a base de anfotericina B31, 32. A pesar de que en nuestro estudio no se observó permeación, si se encontró fármaco retenido dentro de la piel con un valor mayor para la crema con aceite esencial (675.98 µg/g/cm2) en comparación con la crema realizada sin dicho aceite (342.19 µg/g/cm2). Este resultado sugiere que la adición del aceite esencial de B. graveolens mejoró la difusión del fármaco a través de la epidermis y la dermis, posiblemente debido a su contenido rico en terpenos como d–limoneno que según reportes promueve la permeación de fármacos hidrófilos y lipófilos mediante cambios reversibles en el empaquetamiento intercelular y la estructura lipídica del estrato córneo facilitando la difusión del fármaco33. La permeación no detectada y la significativa cantidad de fármaco retenido en la piel para la crema de anfotericina B y aceite esencial de B. graveolens indica que el fármaco no se absorberá y que su efecto será eminentemente local.
Estudios de citotoxicidad
El efecto de diferentes concentraciones de crema formulada a base de anfotericina B y aceite esencial de B. graveolens sobre queratinocitos humanos se evaluó utilizando el ensayo de citotoxicidad MTT. Luego de 24 h de incubación, se observó que las diferentes diluciones ensayadas (1/500 hasta 1/2000) de la crema no afectaron la viabilidad celular, ya que los resultados obtenidos para las células de control fueron similares a los de la incubación de la crema (Figura 3). Por lo tanto, estos resultados sugieren que el producto desarrollo en el presente trabajo no desencadena toxicidad en los queratinocitos.
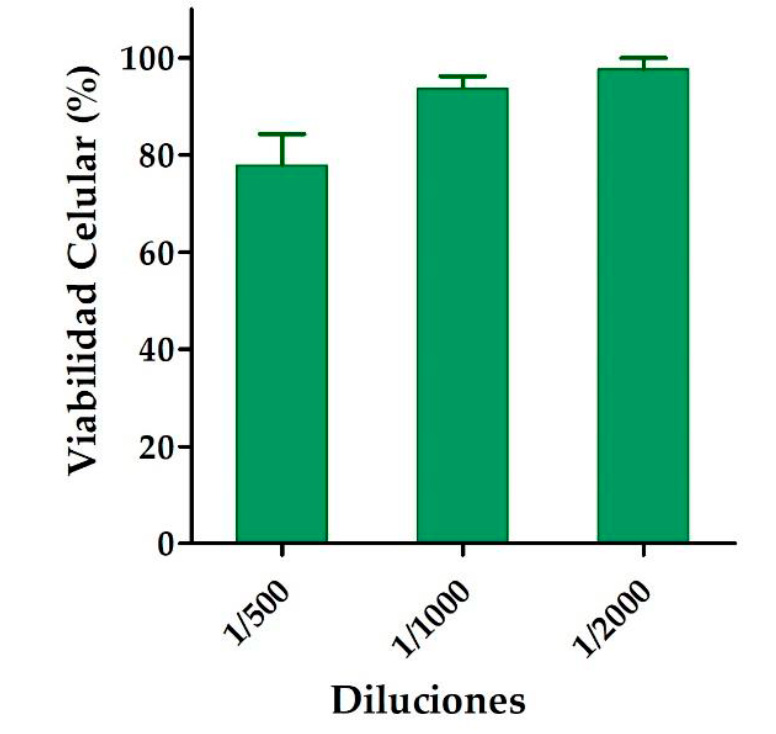
Figura 3. Porcentaje de viabilidad de la línea celular HaCaT expuesta a diferentes concentraciones de la crema de anfotericina B y aceite esencial de B. graveolens.
Estudios de eficacia microbiológica in vitro
En la tabla 3, se detallan los resultados obtenidos para la crema formulada a base de anfotericina B más aceite esencial de B. graveolens y la crema de anfotericina B en ausencia de este aceite.

Tabla 3. Concentración Mínima Inhibitoria frente a C. albicans
La CMI para la crema sin este aceite fue de 0.125 µg/ml mientras que para la crema de anfotericina B y aceite esencial fue de 0.0321 µg/mL, es decir casi 4 veces menor y por lo tanto es más eficaz5, 34. El aumento de la actividad antimicótica proporcionado por la presencia del aceite esencial de B. graveolens podría deberse a sus componentes terpénicos, los cuales le brindan una actividad antifúngica adicional posiblemente mediante inhibición en la síntesis de ergosterol, inhibición enzimática, cambios en la permeabilidad de la membrana y ruptura de ésta induciendo la muerte del patógeno. Actualmente, la terapia combinada de fármacos especialmente antifúngicos con terpenos ha revelado efectos prometedores contra patógenos susceptibles y resistentes. En nuestro estudio, la combinación de anfotericina B con aceite esencial de B. graveolens en una formulación tópica mostró una actividad mejorada contra C. albicans, sugiriendo un posible efecto sinérgico entre los componentes activos de este aceite y el fármaco12, 13.
CONCLUSIONES
La crema de anfotericina B y aceite esencial de B. graveolens desarrollada en este estudio presentó características apropiadas de pH, viscosidad y extensibilidad para la aplicación tópica. Adicionalmente, los estudios de permeación ex vivo y de eficacia antimicrobiana contra C. albicans, demostraron que la presencia del aceite esencial de B. graveolens en la formulación mejora la permeación del fármaco a través de la piel y aumenta la eficacia contra el patógeno aproximadamente 4 veces al comparar con la formulación en ausencia de dicho aceite, lo que la convierte en una alternativa prometedora en el tratamiento de la candidiasis cutánea y motiva a llevar a cabo estudios más profundos para explorar su uso en la práctica clínica.
Author Contributions: LCE y LS han conceptualizado la idea, EV ha realizado la extracción del aceite esencial, OC-SO-LC-TB han realizado las formulaciones y estabilidad física y química. LCE y LS han realizado los ensayos reológicos y de permeción exvivo. NDG y PCG han realizado los ensayos de citotoxicidad. LS y LCE han realizado los análisis estadisticos microbiológicos. LCE, LS y PCG han escrito, analizado y revisado el documento.
Acknowledgments: Agradecemos la colaboración de la Dra. Lyda Halbaut de la Universidad de Barcelona por el apoyo en los estudios reológicos. A la Dra. Ana Calpena de la Universidad de Barcelona por la revisión de los resultados de permeación y retención exvivo.
Conflicts of Interest: «The authors declare no conflict of interest.»
REFERENCES
1. Kollipara R, Peranteau AJ, Nawas ZY, Tong Y, Woc-Colburn L, Yan AC, et al. Emerging infectious diseases with cutaneous manifestations: Fungal, helminthic, protozoan and ectoparasitic infections. J Am Acad Dermatol. 2016;75(1):19-30.
2. Havlickova B, Czaika VA, Friedrich M. Epidemiological trends in skin mycoses worldwide. Wiley-Blackwell. 2008;51(4):2-15.
3. Permana AD, Paredes AJ, Volpe-Zanutto F, Anjani QK, Utomo E, Donnelly RF. Dissolving microneedle-mediated dermal delivery of itraconazole nanocrystals for improved treatment of cutaneous candidiasis. Eur J Pharm Biopharm. 2020;154:50-61.
4. Wall G, Montelongo-Jauregui D, Vidal Bonifacio B, Lopez-Ribot JL, Uppuluri P. Candida albicans biofilm growth and dispersal: contributions to pathogenesis. Curr Opin Microbiol. 2019;52:1-6.
5. Andreu CMF, Martínez DG, Illnait DM, Pururena LM. Sensibilidad in vitro de cepas de Candida frente a fluconazol y Anfotericina B. Rev Cub Med. 2007;59(2).
6. Oliveira Carvalho V, Okay TS, Melhem MS, Walderez Szeszs M, del Negro GM. The new mutation L321F in Candida albicans ERG11 gene may be associated with fluconazole resistance. Rev Iberoam Micol. 2013;30(3):209-12.
7. Yamamoto T, Umegawa Y, Tsuchikawa H, Hanashima S, Matsumori N, Funahashi K, et al. The Amphotericin B-Ergosterol Complex Spans a Lipid Bilayer as a Single-Length Assembly. Biochemistry.2019;58(51):5188-96.
8. Torrado JJ, Espada R, Ballesteros MP, Torrado-Santiago S. Amphotericin B formulations and drug targeting. J Pharm Sci. 2008;97(7):2405-25.
9. Lanternier F, Lortholary O. Liposomal amphotericin B: what is its role in 2008? Clin Microbiol Infect. 2008;14 Suppl 4:71-83.
10. Lopez-Castillo C, Rodriguez-Fernandez C, Cordoba M, Torrado JJ. Permeability Characteristics of a New Antifungal Topical Amphotericin B Formulation with gamma-Cyclodextrins. Molecules. 2018;23(12).
11. Karande P, Jain A, Ergun K, Kispersky V, Mitragotri S. Design principles of chemical penetration enhancers for transdermal drug delivery. Proceedings of the National Academy of Sciences. 2005;102(13):4688-93.
12. Mendez AHS, Cornejo CGF, Coral MFC, Arnedo MCA. Chemical Composition, Antimicrobial and Antioxidant Activities of the Essential Oil of Bursera graveolens (Burseraceae) From Perú. Indian J. Pharm. Educ. Res. 2017;51(3s2):s429-s36.
13. Robles J, Torrenegra R. Triterpenos aislados de corteza de Bursera graveolens (Burseraceae)
y su actividad biologica. Artigo. 2005;15:283-6.
14. Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils–a review. Food Chem Toxicol. 2008;46(2):446-75.
15. Chen J, Jiang QD, Wu YM, Liu P, Yao JH, Lu Q, et al. Potential of Essential Oils as Penetration Enhancers for Transdermal Administration of Ibuprofen to Treat Dysmenorrhoea. Molecules.2015;20(10):18219-36.
16. Carrión-Paladines V, Fries A, Caballero RE, Pérez Daniëls P, García-Ruiz R. Biodegradation of Residues from the Palo Santo (Bursera graveolens) Essential Oil Extraction and Their Potential for Enzyme Production Using Native Xylaria Fungi from Southern Ecuador. Fermentation. 2019;5(3).
17. Rey-Valeirón C, Guzmán L, Saa LR, López-Vargas J, Valarezo E. Acaricidal activity of essential oils of Bursera graveolens (Kunth) Triana & Planch and Schinus molle L. on unengorged larvae of cattle tick Rhipicephalus (Boophilus) microplus (Acari:Ixodidae). Journal of Essential Oil Research. 2017;29(4):344-50.
18. Monzotea L, Hillb GM, Cuellarc A, Scullc R, Setzerb WN. Chemical Composition and Anti-proliferative Properties of Bursera graveolens Essential Oil. Natural Product Communications. 2012;7(11):1531-4.
19. Park EK, Song KW. Rheological evaluation of petroleum jelly as a base material in ointment and cream formulations, steady shear flow behaviour. Arch Pharm Res. 2010;33(6):141–50.
20. Ayala Jara CI. Desarrollo y efecto antimicótico in vitro de una crema de Tropaeolum majus L. (Tropaeolaceae) sobre Trichophyton rubrum (Arthrodermataceae). Arnaldoa. 2018;25(1):105-14.
21. González* MdR, Yeverino ML, Aguirre D, Esquivel P. Estudio exploratorio de los valores de pH en cremas. Revista de ciencias Farmacéuticas y Biomedicina. 2018; Edición especial 2(1):43.
22. Espinoza LC, Vera-Garcia R, Silva-Abreu M, Domenech O, Badia J, Rodriguez-Lagunas MJ, et al. Topical Pioglitazone Nanoformulation for the Treatment of Atopic Dermatitis: Design, Characterization and Efficacy in Hairless Mouse Model. Pharmaceutics. 2020;12(3).
23. D B, MM A, Sessa M HL, Guillén C B-MA, R F, AC C-C, et al. Topical Amphotericin B Semisolid Dosage Form for Cutaneous Leishmaniasis: Physicochemical Characterization, Ex Vivo Skin Permeation and Biological Activity. Pharmaceutics. 2020;12(2):149.
24. Suñè JM, M JFY, Fernandez MPG. Extensibilidad en pomadas. Ars Pharmaceutica 1961;4-5(1):241-7
25. Bhandari PN, Singhal* RS, Kale DD. Effect of succinylation on the rheological profile of starch pastes. Elsevier. 2002;47:365 -71.
26. Ibánez S, Suñé JM. Determinación pH y su relación con la piel. Ars Pharmaceutica. 1969(1):453-67.
27. Gilbert L, Picard C, Savary G, Grisel M. Rheological and textural characterization of cosmetic emulsions containing natural and synthetic polymers: relationships between both data. Colloids Surf. A: Physicochem. Eng. 2013;421:150-63.
28. Sanchez-Quiles I, Najera-Perez MD, Espuny-Miro A, Titos-Arcos JC. [Review of the stabitlity of photosensitive medications]. Farm Hosp. 2011;35(4):204-15.
29. Hagen M, Baker M. Skin penetration and tissue permeation after topical administration of diclofenac. Curr Med Res Opin. 2017;33(9):1623-34.
30. Marwah H, Garg T, Goyal AK, Rath G. Permeation enhancer strategies in transdermal drug delivery. Drug Deliv. 2016;23(2):564-78.
31. Sosa L, Calpena AC, Silva-Abreu M, Espinoza LC, Rincon M, Bozal N, et al. Thermoreversible Gel-Loaded Amphotericin B for the Treatment of Dermal and Vaginal Candidiasis. Pharmaceutics. 2019;11(7).
32. Sosa L, Clares B, Alvarado HL, Bozal N, Domenech O, Calpena AC. Amphotericin B releasing topical nanoemulsion for the treatment of candidiasis and aspergillosis. Nanomedicine. 2017;13(7):2303-12.
33. Yang Z, Teng Y, Wang H, Hou H. Enhancement of skin permeation of bufalin by limonene via reservoir type transdermal patch: formulation design and biopharmaceutical evaluation. Int J Pharm.2013;447(1-2):231-40.
34. Duarte I, Herrera ML. Concentración mínima inhibitoria de Anfotericina B contra Candida albicans. Revista Médica del Hospital Nacional de Niños Dr Carlos Sáenz Herrera. 1995;30:45-50.
Received: 26 September 2023 / Accepted: 15 April 2023 / Published:15 December 2023
Citation: Espinoza L C , Correa O, Sosa L , Días-Garrido N , Ojeda S, Valarezo E, Cartuche L, Bravo T,. Granda P C. Formulación y caracterización de una crema de anfotericina B y aceite esencial de Bursera graveolens para el tratamiento local de la candidiasis cutánea. Revis Bionatura 2023;8 (4) 36. http://dx.doi.org/10.21931/RB/2023.08.04.36



















