Vol 8 No 4 2023 – 23
Evaluación de extractos acuosos de neem (Azadirachta indica) y tabaco (Nicotiana tabacum) para elcontrol del pulgón negro del cacao (Toxoptera aurantii)
Evaluation of neem (Azadirachta indica) and tobaco (Nicotiana tabacum L.) aqueous extracts to control the black cocoa aphid (Toxoptera aurantii)
Mayra Carolina Vélez Ruiz1,* , Karen Lisseth Tapia-Gualpa1
, Karen Lisseth Tapia-Gualpa1 , Favio Eduardo Herrera-Eguez1
, Favio Eduardo Herrera-Eguez1 , Juan José Reyes-Pérez2
, Juan José Reyes-Pérez2
 , Karen Lisseth Tapia-Gualpa1
, Karen Lisseth Tapia-Gualpa1 , Favio Eduardo Herrera-Eguez1
, Favio Eduardo Herrera-Eguez1 , Juan José Reyes-Pérez2
, Juan José Reyes-Pérez2
1 Universidad Técnica Estatal de Quevedo, Facultad de Ciencias Agrarias y Forestales, Campus “La María” km 7 Vía Quevedo-El Empalme, Mocache, Los Ríos, Ecuador; karen.tapia2016@uteq.edu.ec :; (FH) fherrerae@uteq.edu.ec.
2 Universidad Técnica Estatal de Quevedo, Facultad de Ciencias Pecuarias y Biológicas, Campus “La María” km 7 Vía Quevedo-El Empalme, Quevedo, Los Ríos, Ecuador; jreyes@uteq.edu.ec.
* Correspondence: mvelez@uteq.edu.ec.
Available from. http://dx.doi.org/10.21931/RB/2023.08.04.24
RESUMEN
El pulgón negro (Toxoptera aurantii), es una plaga que causa daño a las hojas, flores y frutos pequeños del cacao. En la actualidad se ha incrementado el uso de extractos botánicos con propiedades insecticidas tales como, el neem (Azadirachta indica) y el tabaco (Nicotiana tabacum), los cuales son considerados como una alternativa en el control del pulgón del cacao, sin embargo, muy poco se conoce sobre sus efectos toxicológicos en esta plaga. En este estudio fueron evaluados los efectos insecticidas de los extractos acuosos de neem y tabaco contra T. aurantii en superficies de papel filtro. La mortalidad del pulgón negro fue significativamente afectada al ser expuestos a superficies tratadas con extractos de neem, tabaco o insecticida acetamiprid (P <0,001) después de 6 horas del inicio del bioensayo. El extracto de neem y tabaco en concentración del 0,4 kg L-1 (100%) causó la mortalidad del 100 % y 80 % de los pulgones respectivamente. El valor de la CL50 para los extractos de neem fue de 0,05 kg L-1, y para tabaco fue de 0,18 kg L-1. Los extractos de neem y tabaco producen repelencia en los pulgones al ser expuesto a superficies tratadas con concentraciones del 100 %.
Palabras clave: mortalidad; repelencia; Aphididae; concentración letal media
ABSTRACT
The black aphid Toxoptera aurantii is a pest that causes damage to the leaves, flowers, and small fruits of cocoa. The use of botanical extracts with insecticidal properties such as neem (Azadirachta indica) and tobacco (Nicotiana tabacum) can be considered as an alternative in the control of the cocoa aphid, although very little is known about their effects on this pest. This study evaluated the insecticidal effects of aqueous neem and tobacco extracts against T. aurantii on paper filter surfaces. Black aphid mortality was significantly affected by exposure to surfaces treated with botanical extracts of neem, tobacco, or the insecticide acetamiprid (P <0.001), after 6 hours from the beginning of the bioassay. The extract of neem and tobacco in the concentration of 0.4 kg L-1 caused the mortality of 100 % and 80 % of the aphids, respectively. The LC50 value for neem extracts was 0.05 kg L-1, and for tobacco, it was 0.18 kg L-1. Neem and tobacco extracts produce repellency in aphids when exposed to surfaces treated with 100 % concentrations.
Keywords: mortality; repellency; Aphididae; mean lethal concentration
INTRODUCCIÓN
Para Ecuador, el cacao (Theobroma cacao L.) representa uno de los principales rubros agrícolas, debido a los ingresos económicos que aporta al país, así como, su aporte en la generación de empleo1,2. No obstante, este cultivo presenta una baja productividad debido a razones genéticas, suelos degradados, plagas y enfermedades, lo que sitúa a los productores de cacao en dificultades socioeconómicas1,3. De igual manera, los insectos plaga en el cultivo de cacao pueden limitar su desarrollo y productividad4. Entre las principales plagas se encuentra al pulgón negro (Toxoptera aurantii Boyer) (Hemiptera: Aphididae), es una especie plaga del cultivo de cacao que tiene aparato bucal chupador, succiona la savia del floema de flores, frutos pequeños y brotes vegetativos, causando daños a las plantas5,6. El control con insecticidas constituye el método más rápido de control para pulgones, sin embargo, la aplicación constante de insecticidas genera desequilibrio ambiental, aumenta los costos de producción y causa problemas en la salud de los seres humanos7, por lo tanto, es necesario el uso de métodos alternativos que permitan el control y manejo del pulgón negro. Entre los métodos alternativos para el control de insectos plaga se encuentra el uso de extractos botánicos8,9.
Algunos de los principales beneficios de los extractos botánicos son los siguientes: son seguros para aplicar (baja toxicidad para mamíferos), pueden ser fácilmente procesados y aplicados (no requiere de tecnología sofisticada) y aplicados, además de ser productos ecológicos, tienen compatibilidad con los componentes ambientales10,11. La mayoría de los insecticidas botánicos contienen metabolitos secundarios como: terpenoides, alcaloides, glucósidos y fenoles, moléculas que actúan como defensa de las plantas, además, pueden afectar el comportamiento y fisiología de los insectos6,12,13. Entre las plantas con potencial insecticida para el control de insectos incluyendo pulgones del género Toxoptera destacan el neem (Azadirachta indica) y tabaco (Nicotiana tabacum)14,15. Algunos compuestos que posee A. indicacomo la azadiracnina pueden afectar el sistema nervioso central, sistema muscular, inmunologico y digestivo, además de causar la muerte de diversos grupos de insectos16. Otro compuesto popular conocido como agente insecticida es la nicotina, que se deriva básicamente del tabaco (N. tabacum), tienen efectos directos sobre el sistema nervioso de los insectos17.
En Ecuador muy poco se conoce sobre el control y manejo del pulgón negro del cacao utilizando insecticidas botánicos y mucho menos sobre sus efectos toxicológicos. Por lo anterior, el objetivo de esta investigación fue determinar el efecto toxicológico de los extractos botánicos de A. indica y N. tabacumsobre T. aurantii en el Ecuador.
MATERIALES Y METODOS
Insectos
Adultos y ninfas del T. aurantii fueron colectados de brotes tiernos y flores de una plantación de cacao (Clon CCN51) de la Universidad Técnica Estatal de Quevedo (UTEQ), (Los Ríos, Mocache, Ecuador) (1°04’57,6″S, 79°30’06,7″W). Para la captura de los insectos se utilizó un pincel fino con el que se colectaron ninfas y adultos de pulgón, y los cuales, fueron introducidos en recipientes plásticos. Posteriormente, ninfas y adultos fueron ubicados en jaulas de madera (50 cm x 80 cm) con plántulas de cacao y limón. Las cajas fueron recubiertas con tela transparente (organza) presentando una abertura con velcro en la parte superior. Las cajas fueron mantenidas bajo condiciones de invernadero (temperatura 28 ± 3 °C; 75 ± 10 % de humedad relativa y fotoperiodo 12:12 (D:O)). Los insectos permanecieron por cuatro semanas con las plántulas para su multiplicación. Una vez alcanzada la población de 350 individuos se seleccionaron diez de ellos al azar y se midió su longitud (1,09 ± 0,09 mm de largo), para verificar el estadio de desarrollo en el que se encontraban. Los individuos en los que se tomó los datos de longitud se descartaron para las posteriores pruebas, los restantes, al alcanzar el tercer estadio ninfal fueron destinados para los bioensayos18.
Preparación de extractos botánicos
Los extractos botánicos de A. indica y N. tabacum se elaboraron según la metodología propuesta por López et al., (2015)19. Se colectaron hojas frescas de A. indica y N. tabacum que se encontraban cultivadas en el campus experimental La María (UTEQ, Los Ríos, Mocache, Ecuador). El extracto de N. tabacum se preparó sumergiendo 400 g de hojas frescas de tabaco en 1 L de agua destilada (0,4 kg L-1) en una olla de aluminio inoxidable. Se sometió la mezcla a 80 ºC por 15 min y después, se realizó un proceso de filtrado con un tamiz metálico. A los residuos de las hojas de tabaco obtenidos de la primera extracción se añadió 100 mL de agua destilada y se sometió a calentamiento a una temperatura de 80 ºC por 15 min. Se mezclaron 100 mL del primer proceso de extracción con los últimos 100 mL procesados. La mezcla se filtró en papel filtro (CHMLAB GROUP F2040, 85 g/m2 peso, 32 cm ø, España) para eliminar el exceso de residuos.
Para la obtención del extracto de A. indica se utilizaron hojas frescas y se siguió el proceso antes mencionado. Los extractos obtenidos de A. indica y N. tabacum fueron considerados como el 100 % de concentración (0,4 kg L-1). Posteriormente, se realizaron diluciones seriadas (diluciones con agua destilada en la que se redujo la concentración progresivamente) para obtener las concentraciones requeridas (100 %, 50 %, 10 % y 1 %). Adicionalmente, y dependiendo de los bioensayos se utilizó un insecticida como tratamiento control positivo (Insecticida acetamiprid; Nombre comercial: Acetalaq SP, 200 g i.a./kg; Sinochem, Ningbo LTD, Zhegiang, China) y un tratamiento control negativo (agua destilada).
Bioensayos de supervivencia
Se utilizó un diseño completamente al azar con seis tratamientos por cada bioensayo y cuatro repeticiones por tratamiento. Los tratamientos consistieron en el uso de: i) Extractos de neem en las concentraciones: 100 %, 50 %, 10 % y 1 %, ii) Extractos de tabaco en las concentraciones: 100 %, 50 %, 10 % y 1 %, iii) Insecticida acetamiprid (control positivo) y iv) Agua destilada (control negativo). Cuatro grupos (repeticiones) de cinco insectos (ninfas de T. aurantii de tercer estadio) por tratamiento fueron ubicados usando un pincel fino en cuatro cajas Petri (9 cm de ø y 2 cm de altura) forradas en el fondo con discos de papel filtro (CHMLAB GROUP F2040, 85 g/m2 peso, 9 cm ø, España) y recubierta sus paredes con talco industrial (talco sin olor, malla 325, MAGMIN, Comercializadora S.A.) para prevenir el escape de los insectos. En cada caja Petri se colocaron flores de cacao previamente desinfectadas con hipoclorito de sodio comercial diluido al 0,5% para la alimentación de los insectos. Cada disco de papel filtro fue pulverizado con 1 mL de la concentración correspondiente a cada extracto botánico (neem y tabaco), insecticida (Acetamiprid, 3,14 mg (i.a./cm2) o agua destilada. La aplicación de los tratamientos se realizó utilizando un aerógrafo (Truper Modelo: AERO 35, Jiliotepec, Estado de México, México) conectado a un compresor (Truper, Modelo: COMP-AERO, 1/5 HP, 58 PSI, Jiliotepec, Estado de México, México). La distancia entre el aerógrafo y el papel filtro fue de aproximadamente 20 cm. Al finalizar cada aplicación de los tratamientos, se limpió y desinfectó el aerógrafo con acetona. El papel filtro tratado fue colocado sobre una estructura metálica (parrilla de nevera) para el proceso de secado bajo la campana de laboratorio por un periodo no mayor a cinco minutos a una temperatura de 27 °C. Los experimentos realizados se mantuvieron bajo condiciones controladas (temperatura 27 °C; 75 ± 10 % de humedad relativa; fotoperiodo 12:12 (L:O).
Tiempo Letal medio (TL50)
Para la evaluación de tiempo letal medio (TL50), los pulgones (T. aurantii) se consideraron los tratamientos utilizados en los bioensayos de supervivencia. La mortalidad de cada insecto fue registrada inicialmente a partir de la media hora que estos estuvieron en contacto con los discos de papel filtro tratados. Posterior a ello se evaluó cada hora durante las primeras seis horas y una última evaluación fue realizada a las doce horas. La mortalidad de los individuos de cada tratamiento fue constatada cuando no existía señales de movimiento de los insectos a los toques realizados con un pincel fino20.
Concentración Letal media (CL50)
Utilizando el protocolo descrito anteriormente fueron realizadas pruebas de toxicidad (mortalidad de individuos) a las seis horas posteriores de la exposición de los pulgones (T. aurantii) a los extractos de neem o tabaco para determinar la concentración letal media (CL50). Para este experimento se utilizaron únicamente los tratamientos con extractos botánicos y el tratamiento control negativo (agua destilada). Las concentraciones de extractos de neem y tabaco utilizadas fueron: 100 %, 50 %, 10 %, y 1%. Las diferentes concentraciones de cada extracto fueron usadas para demostrar los efectos dependientes de la concentración con respecto a la supervivencia.
Repelencia (bioensayo de elección pareada)
Para el análisis del comportamiento de repelencia se utilizó los extractos botánicos de neem y tabaco en diferentes concentraciones (100 %, 50 %, 10 % y 1 %) y el tratamiento con insecticida (acetamiprid). Se utilizaron las mismas condiciones previamente descritas. Discos de papel filtro fueron tratados con agua destilada (tratamiento control) (CHMLAB GROUP F2040, 85 g/m2 peso, 9 cm ø, España) y la mitad de otro disco fue tratado a diferentes concentraciones de extractos de neem, tabaco (100 %, 50 %, 10 % y 1 %) o insecticida. La mitad de los discos tratados con extractos o insecticida fueron fijadas sobre el disco de papel tratado con agua destilada utilizando pegamento en barra inoloro (UHU GmbH & Co. KG Herrmannstraße, Bühl/Baden, Alemania)21. Posteriormente fueron colocados en cajas Petri de vidrio (9 cm de ø y 2 cm de altura). Cuatro repeticiones con veinte insectos (ninfas de tercer estadio de T. aurantii) por cada tratamiento fueron liberadas en el centro de la caja en las que se encontraba el papel filtro tratado, con un total de ochenta insectos por cada tratamiento. El número de insectos en cada lado del papel filtro fue evaluado treinta minutos después de que fueron liberados en la caja Petri.
Análisis de datos
Los datos obtenidos en el bioensayo de tiempo letal medio fueron sometidos al análisis no paramétrico de supervivencia usando los estimadores de Kaplan-Meier para obtener las curvas de supervivencia y estimar el tiempo letal medio (TL50). Además, los límites de confianza al 95% fueron establecidos para la variable TL50. Para evaluar la mortalidad de los pulgones se verificó los supuestos de normalidad y homocedasticidad con las pruebas de Shapiro-Wilk y Bartlett respectivamente. Se utilizó el programa RStudio para realizar el análisis de varianza y verificar diferencias entre el porcentaje de mortalidad de T. aurantii entre los tratamientos. Adicionalmente, para comparar las medias obtenidas se utilizó la prueba Post-hoc de Tukey (P <0,05)22. La concentración letal media (CL50) fue obtenida a través de un análisis Probit con los datos de mortalidad de los pulgones en cada tratamiento (Proc probit) utilizando el programa SAS23. Para determinar la repelencia entre los tratamientos se contabilizó el número de insectos ubicados en las cajas Petri que se encontraban en la mitad tratada con extractos botánicos e insecticidas o en la mitad tratada con agua, los datos fueron transformados a porcentaje. Las medias del porcentaje de individuos en cada sección de la caja Petri fueron comparados usando la prueba de t pareada (α <0,05)22.
RESULTADOS Y DISCUSIÓN
Tiempo de supervivencia (TL50)
El análisis de supervivencia mostró, diferencias estadísticas significativas tanto para el bioensayo en el que se utilizaron concentraciones de neem (A. indica) y sus controles (prueba de Log-rank: X2= 136,05, df, 5, P <0,001, Figura 1A) como para, el bioensayo con concentraciones de extracto de tabaco (N. tabacum) y sus respectivos controles (prueba de Log-rank: X2 =137,29, df, 5, P <0,001, Figura 1B). Los tiempos medios de supervivencia (TL50) de los insectos expuestos a superficies tratadas con extracto de neem y tabaco en las concentraciones de 100 %, 50 %, 10 %, 1 %, acetamiprid y agua con sus respectivos intervalos de confianza (95 %) son indicados en la Tabla 1. La mortalidad del pulgón negro del cacao fue significativamente afectada al ser expuestos a superficies tratadas con extractos botánicos o insecticida después de 6 h del inicio del bioensayo (P <0,05). El resultado de mortalidad en los diferentes tratamientos muestra que, los extractos de neem y tabaco en concentración de 100 % causó la mortalidad del 100 % y 80% de los individuos respectivamente después de seis horas de exposición a las superficies tratadas.

Figura 1. Curva de supervivencia (Long Rank Test) de T. aurantii expuestos a superficies tratadas con extractos de A) neem (A. indica). B) y tabaco (N. tabacum), insecticida acetamiprid y agua.
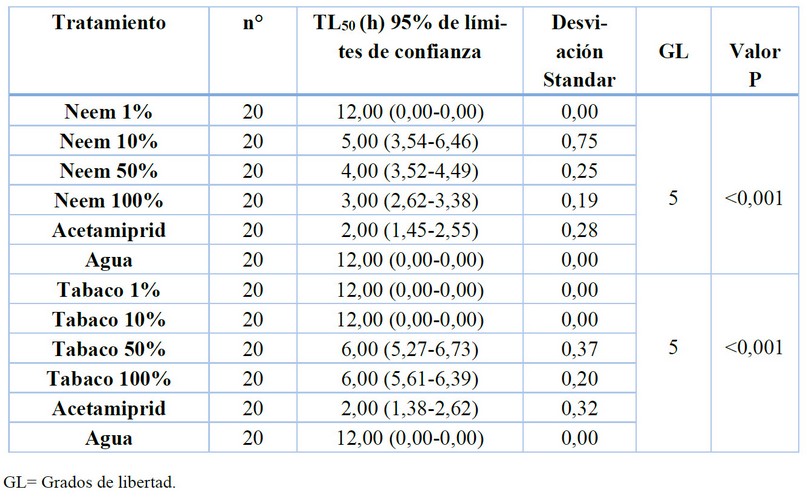
Tabla 1. Tiempo letal medio (TL50) de T. aurantii expuestos a superficies tratadas con extractos de neem (A. indica) y tabaco (N. tabacum), insecticida acetamiprid y agua.
Entre los tratamientos evaluados el insecticida acetamiprid alcanzó la mortalidad más rápida de los pulgones expuestos a superficies tratadas (TL50 = 2 h). Este rápido efecto sobre los pulgones se debe a que acetamiprid es un neonicotinoide que tiene un modo de acción a nivel del sistema nervioso central, actúa como agonista de los receptores nicotínicos de acetilcolina (nAChR’s) responsables de una rápida neurotransmisión excitatoria, causando parálisis y la mortalidad de los insectos 24,25.
El TL50 a las 3 h fue obtenido con la concentración de neem al 100 %, mientras que, el extracto de tabaco alcanza este resultado a las 6 h. Aunque las concentraciones al 100 % de neem y tabaco causaron mortalidad, el tratamiento con neem tuvo un efecto más rápido. El neem, posee compuestos que demuestran su actividad insecticida en el control de más de 200 especies de insectos, incluyendo insectos chupadores tales como: Bemissia tabaci (Gennadius), Myzus persicae (Sulzer), y T. aurantii 15,26,27. Las plantas de tabaco también contienen metabolitos con potencial insecticida, uno de los principales es la nicotina28 y puede actuar sobre el sistema nervioso, sobre el sistema digestivo y como repelente29. El uso de esta especie botánica ha sido efectiva en el control de áfidos, trips, psílidos, tingidos, escarabajos, lepidópteros, ente otros 29,30.
Aunque los extractos botánicos de neem y tabaco han mostrado ser eficientes para el control de T. aurantii15, en este estudio se pudo identificar que el porcentaje de mortalidad y el tiempo de mortalidad varían dependiendo de la especie botánica, la concentración utilizada y el método de aplicación. Diferencias significativas fueron encontradas entre los extractos botánicos (F1,41 = 5,05; P <0,01), en donde, el extracto de neem presentó un efecto en la mortalidad superior al extracto de tabaco. También, fue posible evidenciar diferencias significativas entre los tratamientos en los que se utilizó concentraciones de extractos de A. indica, (F5,18 = 9,78; P <0,01), y de N. tabacum (F5,18 = 7,81; P <0,01) comparadas con el insecticida (acetamiprid) y agua (Tabla 2).

Tabla 2. Porcentaje de mortalidad de pulgones (T. aurantii) expuestos a superficies tratadas con extractos de neem (A. indica), tabaco (N. tabacum), acetamiprid y agua destilada.
Concentración Letal media (CL50)
De acuerdo con el análisis de regresión probit el valor de la CL50 (95 % de intervalo de confianza) para el extracto de neem fue de Log % = 1,07 equivalente a 11,74 % (0,05 kg L-1) (Figura 2A), mientras que, para la evaluación realizada con las concentraciones de tabaco la CL50 (95 % de intervalo de confianza) fue de Log % = 1,66 equivalente a 45,77 % (0,18 kg L-1) (Figura 2B). En las evaluaciones realizadas fue posible evidenciar que para ambos bioensayos el coeficiente de regresión de probit es positivo. Esto indica que, en los dos casos, el porcentaje de mortalidad aumenta a mayor concentración utilizada.
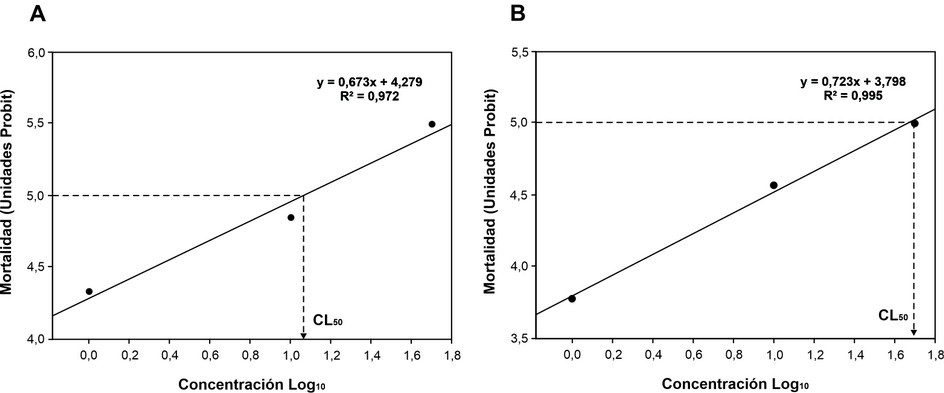
Figura 2. A) Regresión lineal entre la mortalidad en unidades probit y la concentración Log10 de pulgones (T. aurantii) expuestos a superficies tratadas con diferentes concentraciones de extractos naturales de A. indica (Log 1,07) y B) N. tabacum (Log 1,66) después de 6 h del inicio de la exposición.
El neem (A. indica) ha sido utilizado como método de control de plagas y emergentemente como una alternativa viable para pequeños agricultores31. No existe información sobre la CL50 de extractos de neem en T. aurantii aplicados en exposición aguda de contacto a través de superficies de papel filtro, sin embargo; en este estudio fue posible obtener un valor de CL50 = 0,05 kg L-1. La estimación obtenida de CL50 muestra que, T. aurantii es susceptible al uso de extractos de neem. Esto se puede atribuir al alto contenido de azadiractina, compuesto considerado el más potente de los limonoides con actividad tóxica para los artrópodos, lo que puede contribuir al control de insectos chupadores. Como resultado, valores más bajos de CL50 significan una mayor toxicidad y, en consecuencia, se requiere cantidades más pequeñas del extracto para matar al 50 % de la población que estuvo expuesta.
La CL50 para pulgones expuestos a superficies de papel filtro tratadas con extractos de neem tampoco ha sido registrada anteriormente. El resultado de la CL50 obtenido en este estudio es equivalente a 0,18 kg L-1, mostrando que se requieren mayores concentraciones del extracto para causar la mortalidad del 50 % de individuos tratados. La aplicación de extractos tanto de neem como de tabaco sobre papel filtro simula el contacto de los pulgones sobre las superficies tratadas en la planta de cacao.
Repelencia (bioensayo de elección pareada
El análisis de repelencia entre la proporción de pulgones (T. aurantii) que seleccionaron superficies tratadas con extracto de A. indica e insecticida (Acetamiprid) contra la superficie no tradada (agua), mostró diferencias significativas únicamente para los tratamientos en los que se utilizó insecticida (Acetamiprid) (t1,3= 17,45; P <0,001) y extracto de neem en la concentración del 100% (t1,3= 5,18; P <0,001). En estos tratamientos el 8 % y 28% de pulgones permanecieron en el lado tratado con insecticida y extracto de neem al 100% respectivamente (Figura 3A). Situación similar ocurrió para el ensayo en los que se utilizó extractos de tabaco en diferentes concentraciones e insecticida contra el lado no tratado (agua). Se encontraron diferencias entre los tratamientos en los que se utilizó insecticida (t1,3= 35,5; P <0,001) y extracto de tabaco en la concentración del 100% (t1,3= 3,21; P <0,001). En estos tratamientos el 7 % y 38% de pulgones permanecieron en el lado tratado con insecticida y extracto de neem al 100% respectivamente (Figura 3B).
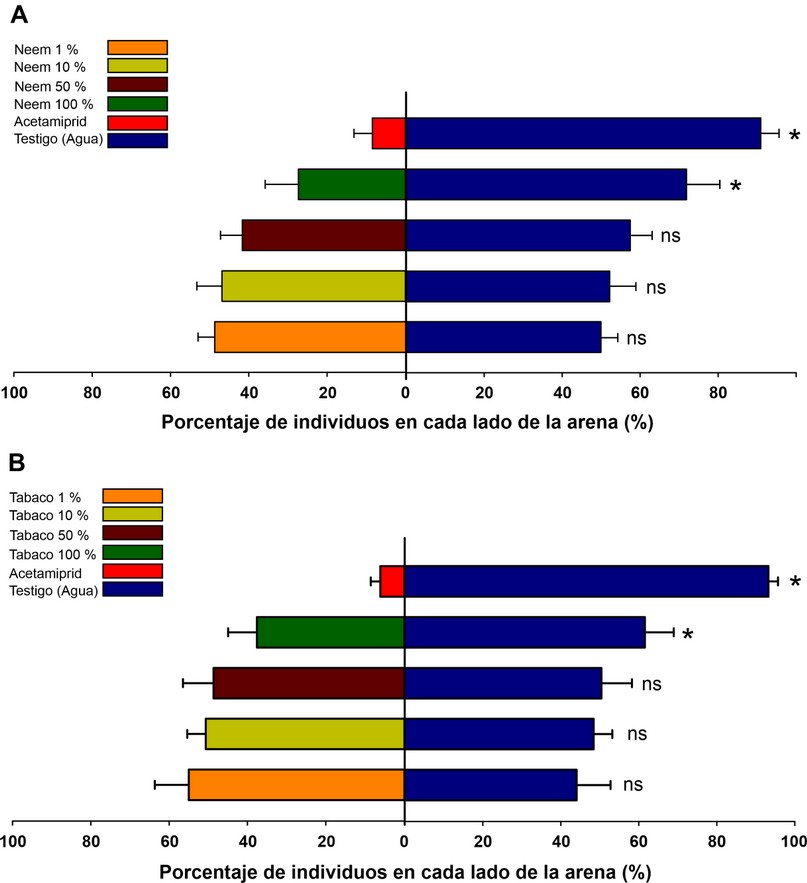
Figura 3. Pulgones (T. aurantii) expuestos a superficies tratadas con diferentes concentraciones de extractos naturales de A) neem (A. indica), B) y de tabaco (N. tabacum), insecticida acetamiprid y agua destilada. Las barras azulesrepresentan la mitad del papel filtro tratado con agua destilada y las barras de colores la mitad del papel filtro tratadocon las concentraciones de los extractos e insecticida. Los asteriscos indican diferencias significativas entre lassuperficies del control y los extractos o insecticida. Prueba t pareada a un nivel de significancia del 5 %.
El porcentaje de repelencia observado fue mayor en las superficies tratadas con insecticida; como fue mencionado anteriormente el acetamiprid es un compuesto que actúa sobre el sistema nervioso de los insectos; puede presentar acción de contacto u oral25,32. Concentraciones de acetamiprid que son consideradas bajas son capaces de inhibir rápidamente la locomoción del insecto33. En este estudio, tal como lo ocurrido con el tratamiento de insecticida, la concentración de 100% de extractos neem y tabaco mostró altos porcentajes de repelencia. Las hojas de neem y tabaco son repelentes para insectos debido a la presencia de compuestos como la azadiractina y la nicotina respectivamente34;35. La nicotina, así como la clase de pesticidas sintéticos neonicotinoides, se dirigen al sistema nervioso de los insectos al actuar como agonistas o antagonistas con sitios de unión de nAChR36, así mismo, la azadiractina, produce alteraciones en el sistema nervioso central de los insectos37. Probablemente, el modo de acción de los extractos de neem y tabaco estén directamente relacionado con los resultados obtenidos. Los resultados de este estudio sugieren que la aplicación de extractos botánicos de neem y tabaco en superficies tratadas son eficientes para el control de T. aurantii, su uso podría tornarse en una alternativa adicional para el control de esta plaga; especialmente para los pequeños productores de cacao y considerando el enfoque ecológico de cada plantación. Estudios adicionales deben ser realizados para evaluar el uso de extractos botánicos de A. indica y N. tabacum utilizando diferentes concentraciones y formas de extracción (maceración, decocción y fermentación). Adicionalmente, es necesario considerar la aplicación de extractos acuosos de A. indica y N. tabacum directamente en las estructuras consumidas por el pulgón (brotes tiernos, flores de cacao) o sobre el propio cuerpo del pulgón en condiciones naturales.
CONCLUSIONES
El extracto de A. indica y N. tabacum en concentración del 100 % ocasiona la mortalidad del 100 % y 80 % de los pulgones expuestos a superficies tratadas respectivamente. El TL50 de los pulgones expuestos a los extractos de neem o tabaco depende de la concentración usada. La CL50 para extractos de neem fue de 0,05 kg L-1 % y para tabaco de 0,18 kg L-1. Los extractos de neem y tabaco en concentración del 100 %, causan la repelencia del pulgón (T. aurantii) en un 70 % y 60 % respectivamente al ser expuestos a superficies tratadas. El uso de extractos botánicos de A. indica y N. tabacum son eficientes en el control de T. aurantii en condiciones controladas, sin embargo; es necesario verificar sus efectos en condiciones de campo como posible alternativa para el control de esta plaga y considerando su efecto sobre otros organismos que conforman el agroecosistema de cacao.
Contribuciones de los autores: Conceptualización, M.V., K.T.G. y J.P.R.; metodología, M.V. y J.P.R., análisis formal, M.V., K.T.G. y F.H.E.; investigación, M.V., K.T.G.; curación de datos, M.V. y F.H.E.; escritura: preparación del borrador original, K.T.G y J.P.R.; escritura: revisión y edición, M.V., J.P.R y F.H.E.; supervisión, M.V.; administración del proyecto, M.V.; K.T.G.; adquisición de fondos, M.V. Todos los autores han leído y aceptado la publicación de este manuscrito.
Financiamiento: Esta investigación es apoyada por el Fondo Competitivo de Investigación Científica y Tecnológica (FOCICYT) 7ma Convocatoria, a través del proyecto PFOC7-20-2020.
Agradecimientos: Al Ing. Erick García, responsable del laboratorio de Química y Bioquímica de la Universidad Técnica Estatal de Quevedo por el apoyo durante la ejecución de los experimentos.
Conflictos de Interés: Los autores declaran no tener conflicto de interés.
REFERENCES
1. Morales IFL, Carrillo ZMD, Ferreira NJA, Peña GMM, Briones CWR, Albán MMN. Cadena de comercialización del cacao nacional en la provincia de Los Ríos, Ecuador. Revista Ciencia y Tecnología. 2018; 11(1):63–9. DOI:10.18779/cyt.v11i1.222
2. Alcivar CKS, Campoverde JQ, Unda SB, Montealegre VJG, Romero HC. Análisis económico de la exportación del cacao en el Ecuador durante el periodo 2014–2019. Polo del Conocimiento: Revista científico-profesional. 2021; 6(3):2430–44.
3. Armengot L, Ferrari L, Milz J, Velásquez F, Hohmann P, Schneider M. Cacao agroforestry systems do not increase pest and disease incidence compared with monocultures under good cultural management practices. Crop prot. 2020; 130:105047. DOI: 10.1016/j.cropro.2019.105047
4. Serrana JM, Ormenita LAC, Almarinez BJM, Watanabe K, Barrion AT, Amalin DM. Life history and host plant assessment of the cacao mirid bug Helopeltis bakeri poppius (Hemiptera: Miridae). Phytoparasitica. 2022; 50(1):1–12. DOI: 10.1007/s12600-021-00957-1
5. Killiny N, Harper SJ, Alfaress S, El Mohtar C, Dawson WO. Minor coat and heat shock proteins are involved in the binding of citrus tristeza virus to the foregut of its aphid vector, Toxoptera citricida. Appl. Environ. Microbiol. 2016; 82(21):6294–302. DOI: 10.1128/AEM.01914-16
6. Gholamzadeh-Chitgar M, Pourmoradi S. An evaluation of the effect of botanical insecticide, palizin in comparison with chemical insecticide, imidacloprid on the black citrus aphid, Toxoptera aurantii Boyer de Fonscolombe and its natural enemy, Aphidius colemani Viereck. J. Plant Prot. Res. 2017; 57(2). DOI: 10.1515/jppr-2017-0013
7. Yan X, Yuan H, Zhou X, Wang M, Shi X, Chen Y, et al. Control efficacy of different pesticide formulations and fan-nozzle model on wheat aphids by UAVs. Int. J. Precis. Agric. Aviat. 2020; 3(2).
8. Zuhra B, Ahmad K, Ali S, Hussain A, Nafees MA, Ali S, et al. Assessing the toxic potential of insecticide and indigenous botanical extract against the stored grain pest Tribolium castaneum(Coleoptera: Tenebrionidae). Pol. J. Environ. Stud. 2018; 5:2377–83. DOI: 10.15244/pjoes/79436
9. Rioba NB, Stevenson PC. Opportunities and scope for botanical extracts and products for the management of fall armyworm (Spodoptera frugiperda) for smallholders in Africa. Plants. 2020; 9(2):207. DOI: 10.3390/plants9020207
10. Tarcaya VP, Di Leo Lira PM del R, Cufre IM, González S, Clemente SV, Broussalis AM. Ovidia andina: actividad insecticida, extracto y compuestos activos. Rev. Latinoam. de química. 2014; 42(1); 89–96.
11. Rahman S, Biswas SK, Barman NC, Ferdous T. Plant extract as selective pesticide for integrated pest management. Biotec. Res. J. 2016; 2(1):6–10.
12. Bezerra CWF, de Oliveira CRF, Cysneiros CH, Matos TGF da S, Alves JJA, Fonseca KS. Effect of Prosopis juliflora and Ziziphus joazeiro plant extracts on Stethorus tridens predatory behaviour on Tetranychus bastosi. Bull. Insectology. 2021; 74(2):265–71.
13. de Paula JAM, Castiglioni GL, Brito LF. Mechanical Drying of Azadirachta indica A. Juss. Seeds: a Tool to Keep Quality of this Eco-Friendly Bio-Insecticide. Front., J. Soc., Technol. Environ. Sci. 2021; 11(1), 39-44. DOI: 10.21664/2238-8869.2022v11i1.p39-44
14. Benelli G, Canale A, Toniolo C, Higuchi A, Murugan K, Pavela R, et al. Neem (Azadirachta indica): towards the ideal insecticide? Nat. Prod. Res. 2017; 31(4):369–86. DOI: 10.1080/14786419.2016.1214834
15. Sohail A, Hamid FS, Waheed A, Ahmed N, Aslam N, Zaman Q, et al. Efficacy of different botanical materials against aphid Toxoptera aurantii on tea (Camellia sinensis L.) cuttings under high shade nursery. J. Mater. Environ. Sci. 2012; 3(6):1065–70.
16. Raj A. Toxicological effect of Azadirachta indica. Asian J. Multidiscip. Stud. 2014; 2(9): 29–33.
17. Islam W, Noman A, Akutse KS, Qasim M, Ali H, Haider I, Hashem M. et al. Int. J. Trop. Insect Sci. Phyto-derivatives: an efficient eco-friendly way to manage Trogoderma granarium (Everts)(Coleoptera: Dermestidae). 2021; 41, 915–926.
18. Firempong S. Biology of Toxoptera aurantii (Homoptera: Aphididae) on cocoa in Ghana. J. Nat. Hist. 1977; 11(4):409–16.
19. López SMC, Urbano JM, López MN. Efectos alelopáticos de extractos acuosos de arvenses sobre la germinación de trigo duro y Lolium rigidum. In: XV Congreso de la Sociedad Española de Malherbología: La Malherbología y la transferencia tecnológica (2015), p 21-28. Junta de Andalucía: Consejería de Agricultura, Pesca y Desarrollo Rural; 2015.
20. Asoufi HM, Al-Antary TM, Awwad AM. Green route for synthesis hematite (α-Fe2O3) nanoparticles: Toxicity effect on the green peach aphid, Myzus persicae (Sulzer). Environ. Nanotechnol. Monit. Manag. 2018; 9:107–11. DOI: 10.1016/j.enmm.2018.01.004
21. Abdelkader H, Abdelkader B, Yahia B. Toxicity and repellency of Eucalyptus globulus L. essential oil against Aphis fabae Scopoli, 1763 (Homoptera: Aphididae). J. Ent. Res. 2020; 44(1):147–52. DOI: 10.5958/0974-4576.2020.00027.4
22. RStudio T. RStudio: integrated development for R. Rstudio Team, PBC, Boston, MA URL http://www rstudio com. 2020.
23. SAS Institute. SAS/STAT user’s guide. Cary, NC: SAS Institution; 2008.
24. Salazar GE, Palomino AL, García HE. Adsorción de neonicotinoides usando estructuras tipo fullereno: Un estudio DFT. Nova scientia. 2018; 10(21):326–43. DOI: 10.21640/ns.v10i21.1572
25. Cheng X, Li F, Chen J, Wang H, Mao T, Li J, et al. Mechanism of trace acetamiprid‐caused reproductive disorders in silkworm, Bombyx mori. Pest Manag. Sci. 2019; 75(10):2672–81. DOI: 10.1002/ps.5373
26. Shannag HS, Capinera JL, Freihat NM. Efficacy of different neem-based biopesticides against green peach aphid, Myzus persicae (Hemiptera: Aphididae). Int. J. Agric. Policy Res. 2014 ;2(2):61–8.
27. Castillo-Sánchez LE, Jiménez-Osornio JJ, Delgado-Herrera MA, Candelaria-Martínez B, Sandoval-Gío JJ. Effects of the hexanic extract of neem Azadirachta indica against adult whitefly Bemisia tabaci. J Entomol. Zool. Stud. 2015; 5:95–9.
28. Archna Tiwari, M. M. Lakshamana Kumar & R. C. Saxena. Effect of Nicotiana tabacum on Tribolium castaneum. Int. J. pharmacogn. 1995; 33(4):348–50. DOI: 10.3109/13880209509065392
29. Sarker S, Lim UT. Extract of Nicotiana tabacum as a potential control agent of Grapholita molesta(Lepidoptera: Tortricidae). PLoS One. 2018; 13(8):e0198302. DOI: 10.1371/journal.pone.0198302
30. Tavares WR, Barreto M do C, Seca AML. Aqueous and ethanolic plant extracts as bio-insecticides—Establishing a bridge between raw scientific data and practical reality. Plants. 2021; 10(5):920. DOI: 10.3390/plants10050920
31. Silva MS, Broglio SMF, Trindade RCP, Ferrreira ES, Gomes IB, Micheletti LB. Toxicity and application of neem in fall armyworm. Comun. Sci. 2015; 6(3):359–64. DOI: 10.14295/cs.v6i3.808
32. Fogel MN, Schneider MI, Desneux N, González B, Ronco AE. Impact of the neonicotinoid acetamiprid on immature stages of the predator Eriopis connexa (Coleoptera: Coccinellidae). Ecotoxicology. 2013; 22:1063–71. DOI: 10.1007/s10646-013-1094-5
33. Rust MK, Saran RK. Toxicity, repellency, and effects of acetamiprid on western subterranean termite (Isoptera: Rhinotermitidae). J. Econ. Entomol. 2008; 101(4):1360–6. DOI: 10.1603/0022-0493(2008)101[1360:traeoa]2.0.co;2
34. Jufri M, Irmayanti E, Gozan M. Formulation of tobacco based mosquito repellent to avoid dengue fever. Int. J. Pharmtech. Res. 2016; 9(7):140–5.
35. Roychoudhury R. Neem products. In: Ecofriendly pest management for food security. Elsevier; 2016. p. 545–562. DOI: 10.1016/B978-0-12-803265-7.00018-X
36. Gog L, Vogel H, Hum-Musser SM, Tuter J, Musser RO. Larval Helicoverpa zea transcriptional, growth and behavioral responses to nicotine and Nicotiana tabacum. Insects. 2014; 5(3):668–88. DOI: 10.3390/insects5030668
37. Chaudhary S, Kanwar RK, Sehgal A, Cahill DM, Barrow CJ, Sehgal R, et al. Progress on Azadirachta indica based biopesticides in replacing synthetic toxic pesticides. Front. Plant Sci. 2017; 8:610. DOI: 10.3389/fpls.2017.00610
Received: 28 September 2023/ Accepted: 15 November 2023 / Published:15 December 2023
Citation. Vélez, R.M.C.; Tapia-Gualpa, K.L.; Reyes-Pérez, J.J.; Herrera-Eguez, F.E. Evaluación de extractos acuosos de neem (Azadirachta indica) y tabaco (Nicotiana tabacum) para el control del pulgón negro del cacao (Toxoptera aurantii).Revis Bionatura 2023;8 (4) 24. http://dx.doi.org/10.21931/RB/2023.08.04.24



















