Vol 8 No 2 2023 – 3

Microencapsulación de licopeno extraido de los desechos agroindustriales del tomate de árbol (Solanum Betaceum).
Microencapsulation of lycopene extracted from the agroindustrial waste of the tree tomato (Solanum Betaceum).
Pilar Pazmiño Miranda 1* , Danae Fernández 2
, Danae Fernández 2 , Diana Coello-Fiallos 3
, Diana Coello-Fiallos 3 , Orestes Darío López* 4
, Orestes Darío López* 4 and Antonio Iraizoz 5
and Antonio Iraizoz 5
 , Danae Fernández 2
, Danae Fernández 2 , Diana Coello-Fiallos 3
, Diana Coello-Fiallos 3 , Orestes Darío López* 4
, Orestes Darío López* 4 and Antonio Iraizoz 5
and Antonio Iraizoz 5
1-4 Universidad Técnica de Ambato, Ecuador
5 Universidad de la Habana, Cuba
* Correspondence od.lopez@uta.edu.ec; nd.pazmino@uta.edu.ec
Available from: http://dx.doi.org/10.21931/RB/2023.08.02.3
RESÚMEN
Se realizó a escala industrial el proceso extracción y microencapsulación de licopenos a partir de los desechos agroindustriales del tomate de árbol (Solanum betaceum) mediante secado por aspersión. Se obtuvo el extracto a partir del secado y molido del material vegetal a la temperatura de 50 °C durante 55 horas hasta obtener un tamaño de partículas finas (≤ 250 µm), posteriormente se utilizó etanol al 96% en una relación material vegetal/volumen de disolvente 1:70. El microencapsulado fue obtenido a partir de una mezcla del 30 % de extracto, 35 % goma arábiga y 35 % de maltodextrina utilizando un secador por aspersión industrial de 100 kg/h de capacidad de evaporación de agua, empleando una temperatura de entrada de 120 °C y una temperatura de salida de 80 °C.
Los extractos presentaron una eficiencia de extracción de: 48,90 mg/kg en el lote 1, 31,10 mg/kg en el lote 2 y de 27,08 mg/kg en el lote 3. Las concentraciones de licopenos alcanzaron valores de: 43,78 mg/g, 45,20 mg/g y 43,22 mg/g en los lotes 1, 2 y 3 respectivamente. La eficiencia de microencapsulación obtenida fue superior al 90% en los lotes producidos a escala industrial (lote 1: 93,61 %, lote 2: 90,44 % y lote 3: 96,78 %). Se evaluó la capacidad antioxidante in vivo de los microencapsulados, utilizando un cultivo de Saccharomyces cerevisiae, demostrando que tienen una actividad antioxidante similar a la de la vitamina C. Mediante el método del DPPH, se obtuvo un porcentaje de inhibición del 48,03 %, 35,07 % y 38,07 % en los 3 lotes respectivamente. En la morfología de las microcápsulas se observaron esferas con superficie lisa con tamaños de microcápsulas del orden de decenas de micrómetros (10 -70 µm) para su diámetro.
Se demuestra que el proceso de microencapsulación de licopeno es efectivo por lo que puede para ser introducido a nivel industrial, siendo una tecnología que puede ser implementada en la industria para el aprovechamiento de los desechos agroindustriales de las cáscaras de tomate de árbol, brindando beneficios para la salud por sus características antioxidantes.
Palabras clave: extracto; carotenoides; licopeno; secado por aspersión, microcápsulas.
ABSTRACT
The extraction and microencapsulation of lycopene from tree tomatoes (Solanum betaceum) were done on an industrial scale by spray drying. The methodology used to obtain the extract was drying at 50 °C for 55 hours until a fine particle size (≤ 250 µm) was accepted, followed by dilution with 96% ethanol and, to obtain the microencapsulation, the extract was mixed with 85% gum arabic and 15% distilled water to pass through an industrial spray dryer of 100 kg/h of water evaporation capacity, using an inlet temperature of 120 °C and an outlet temperature of 80 °C.
As a result, both the liquid extract and the microencapsulated extract were characterized, obtaining three batches with an extraction efficiency of batch 1: 48.90 mg/kg, batch 2: 31.10 mg/kg and batch 3: 27.08 mg/kg. A lycopene concentration of 43.78 mg/g, 45.20 mg/g and 43.22 mg/g and a microencapsulation efficiency of 93.61 %, 90.44 % and 96.78 %. The in vivo antioxidant capacity of the microencapsulates was evaluated in Saccharomyces cerevisiae, demonstrating that they have an antioxidant activity similar to that of vitamin C. And by the DPPH method found an inhibition percentage of 48.03 %, 35.07 % and 38.07 % in the 3 batches, respectively. In the morphology of the microcapsules, spheres with smoothness were observed with microcapsule sizes in the order of tens of micrometers (10 -70 µm) for their diameter.
It is demonstrated that the lycopene microencapsulation process is effective so that it can be introduced at the industrial level. This technology can be implemented in the industry to use the agro-industrial waste of tree tomato peels, providing health benefits for its antioxidant characteristics.
Keywords: extract; carotenoids; lycopene; spray drying; microcapsules.
INTRODUCTION
La cáscara de tomate de árbol es un desecho que se produce industrialmente en las plantas procesadoras de alimentos, siendo un problema de carácter ambiental y económico para las empresas, al convertirse en un desecho sin aprovechamiento. 1
El ser humano, deja de aprovechar las propiedades beneficiosas de las cáscaras de las frutas, sin embargo científicamente se ha demostrado que contienen fibra y compuestos bioactivos 2. Su uso representaría mayores fuentes de ingreso económico y alternativas para su aprovechamiento.
Una manera de aprovechar las cáscaras de tomate de árbol sería mediante procesos físico-químicos para extraer metabolitos secundarios, como son los carotenoides 3. El licopeno, es un carotenoide responsable del color rojo del tomate de árbol 4, se ha demostrado que el licopeno es un carotenoide con actividad antioxidante 5 beneficioso para la salud humana, pues reduce el colesterol LDL, disminuye la cantidad de infartos, combate algunos tipos de cáncer y reduce el envejecimiento celular 6. Siendo ésta una alternativa, para el aprovechamiento de los desechos agroindustriales provenientes del tomate de árbol.
El licopeno no es estable, debiendo su degradación a efectos de la temperatura, la luz u otros efectos de condiciones ambientales 7, razón por la que se debe buscar alternativas o métodos de conservación como es la microencapsulación mediante el secado por aspersión para proteger al licopeno de la oxidación 8.
Existen investigaciones previas de obtención de carotenoides a nivel laboratorio y nivel de banco, 9–12 el objetivo de la presente investigación es evaluar industrialmente el proceso extracción y microencapsulación del licopeno a partir de los desechos del tomate de árbol (Solanum betaceum) mediante secado por aspersión.
MATERIALES Y MÉTODOS
La obtención del extracto y microencapsulado de licopeno se realizó en la empresa Andes Kinkuna S.A. ubicada en Pujilí-Ecuador y los análisis físico-químicos, capacidad antioxidante se realizaron en la Universidad Técnica de Ambato, Facultad de Ciencia en Ingeniería en Alimentos y Biotecnología.
Obtención del extracto de Licopeno
Se trabajó a nivel industrial a partir de cáscaras del tomate de árbol (Solanum betaceum) que constituyen el residual de la fabricación de pulpa de tomate de árbol de una empresa procesadora de frutas.
Las cáscaras de tomate de árbol (Solanum betaceum), posteriormente se secaron a una temperatura de 50 °C durante 55 horas y fueron molinadas en un molino de cuchillas hasta obtener un tamaño de partículas finas (≤ 250 µm) de acuerdo a la metodología de Cardona Et.al 13.
Para la obtención del extracto, se mezclaron en una relación de material vegetal/volumen de disolvente de 1:70, el disolvente orgánico que se empleó fue etanol industrial al 96 %, con un tiempo de extracción de 30 minutos a una temperatura de 50 °C 9. Se produjeron 3 lotes consecutivos de extractos.
Obtención del microencapsulado
Una vez obtenido el extracto de licopeno, se realizó una mezcla con 85 % de goma arábiga y maltodextrina y 15 % de agua destilada , para luego pasar a una homogenización de 200 min-1 durante 10 minutos y microencapsular en un secador por aspersión industrial de 100 kg/h de capacidad de evaporación de agua, empleando una temperatura de entrada de 120 °C y una temperatura de salida de 80 °C 9.
Eficiencia de Extracción
Se determinó la eficiencia de extracción a través de la relación entre la masa de licopenos extraídos (mL) y la masa de material vegetal (MV) utilizado, expresado en la ecuación I14.

Ecuación 1. Porcentaje de eficiencia de extracción
Donde:
mL=masa de licopenos extraídos
mv= masa del material vegetal
Concentración de Licopeno
Se utilizó el etanol como blanco, en donde se midió la absorbancia de cada extracto a una longitud de onda de 472 nm, el equipo que se utilizó fue el espectrofotómetro Fisher Scientific accuSkan GO. La ecuación II, se expresa en mgL-1 15.

Ecuación II. Concentración de Licopeno
Donde:
A= absorbancia del extracto a 472nm
E= coeficiente de absortividad del etanol de 3450
Eficiencia de microencapsulación
Se realizó una dilución 1/10 de los lotes de microencapsulado tanto en agua como en etanol al 96 %, posteriormente estas soluciones se agitaron durante un tiempo de 15 minutos, se filtraron y se midió su absorbancia en el espectrofotómetro Fisher Scientific accuSkan GO a 515 nm 16.

Ecuación III. Eficiencia de microencapsulación
Donde:
CA= concentración de licopeno en agua
CE= concentración de licopeno en etanol
Determinación de pH
Las muestras del extracto, se determinaron por triplicado con el pH-metro (Thermo Scientific ORION VERSASTAR)
Determinación de índice de refracción
Las muestras del extracto se determinaron por triplicado en el refractómetro Abbe Nar 2T a temperatura ambiente. 17
Determinación de viscosidad
Las muestras del extracto se determinaron por triplicado con el viscosímetro Quimis, las muestras fueron tomadas a temperatura ambiente
Determinación de humedad
A las muestras del microencapsulado, se le determinó la humedad por triplicado empleando una balanza Citizen MB 50, colocando una muestra de 5 g en el plato. El resultado obtenido fue expresado en porcentaje.
Espectroscopía Infrarroja de la transformada de Fourier
Se comparó un lote del extracto sin microencapsular, con los tres lotes del microencapsulado en un intervalo desde 500 hasta 4000 cm-1, el equipo que se usó fue FTIR espectrofotómetro Perkin Elmer Spectrum Two.
Morfología y aspecto de la superficie de las microcápsulas
Se estudió la morfología de las microcápsulas empleando un Microscopio Electrónico de Barrido (SEM) modelo Tescan Vega3 con aumento hasta 10000X. Las muestras de 3 lotes de licopeno microencapsulado se prepararon y fijaron sobre cinta de carbono de doble faz que se adhiere en un portamuestras de aluminio de 13mm; y al ser un material orgánico se recubrieron con una fina capa de oro utilizando un dispositivo de recubrimiento por pulverización catódica SPI-Module proceso necesario para que la muestra a ser analizada sea conductora de los electrones que emergen de la fuente de tungsteno del equipo. La obtención de las imágenes se realizó con una energía de 8 a 10 keV (HV High Voltage) en alto vacío (HV High Vacuum) con el detector de Electrones Secundarios (SE).
Actividad antioxidante in vivo
Se usó Saccharomyces cerevisiae ATCC 9763 como modelo de estudio, partiendo de una cepa de reserva de Saccharomyces cerevisiae, cultivada en el medio compuesto por extracto de levadura, peptona, dextrosa, (YPD) mediante siembra en estría durante 5 días a una temperatura de 28 °C.
Posteriormente se inoculó la cepa de Saccharommyces cerevisiae en 5 ml de caldo YPD incubándola a 28 °C durante 24 horas.
Al siguiente día se tomaron 5 L de esa solución y se colocaron en 3 ml de caldo YPD, tomando esta solución como solución estándar para todos los tubos.
Se preparó una solución de peróxido de hidrógeno 0,5 mmol/L y de 5 mmol/L, además de soluciones de microencapsulados a una concentración de 25 mg/ml.
También se preparó una solución de vitamina C, con 25 mg/ml (control positivo)
En cada tubo se fue añadiendo 5 L de la solución de levadura más 3 ml del caldo YPD y 1 ml de las soluciones preparadas, dejando un tubo únicamente con los 3 ml de caldo YPD y los 5 L de la solución de levadura (denominado tubo control)
Estas soluciones fueron llevadas a incubación durante 18 horas a 28 °C.
Al siguiente día se centrifugaron a 2700 min-1 durante 10 min, luego se eliminó el líquido, quedando la levadura precipitada, la cual fue lavada con una solución búfer fosfato salino de pH 7,2, midiendo la absorbancia de cada tubo y ajustandola a 600 nm.
Posteriormente en cada tubo se añadieron las soluciones de peróxido de hidrógeno 0,5 mmol/l y 5 mmol/l, a excepción de en los tubos control, pues a estos tubos no se les añadió peróxido.
Nuevamente se centrifugó a 2700 min-1 durante 10 minutos, eliminando la parte acuosa y con el precipitado, que es Saccharommyces cerevisiae, se realizó un lavado con solución de búffer fosfato salino, luego se añadió en cada tubo 3 ml de caldo YPD.
Finalmente en la placa de 96 pocillos se tomaron 250 L de cada una de las soluciones, se midieron en el espectrofotómetro Fisher Scientific accuSkan GO a 30 °C durante 18 horas, las mediciones se realizaron por triplicado, con las que se construyeron las curvas de crecimiento18,19.
Actividad antioxidante in vitro
Se utilizó el método del 2,2-difenil-1-picrilhidrazilo (DPPH) 20.
El cual consistió en preparar una solución madre de 500 ·10-6 mol/l de Trolox (0,0129 g de Trolox en 50 ml de etanol al 96 % y 50 ml de agua destilada).
Posteriormente se realizaron varias diluciones a partir de la solución madre, obteniendo estándares de: 50 µmol/l, 100 µmol/l, 200 µmol/l, 300 µmol/l, 400 µmol/l y 500 µmol/l. También se preparó una solución de 150 ·10-6 mol/l de DPPH. Estas soluciones se protegieron de la luz y del calor.
Adicional se realizó una dilución de los tres lotes de microencapsulado en polvo 1/200 en una solución de agua-etanol 50:50.
Luego se realizó una dilución 1/200 de los tres lotes del concentrado del extracto en una solución de agua -etanol 50:50.
Posteriormente se colocó en la placa de 96 pocillos, 20 ul de cada una de las soluciones preparadas con 180 ml de la solución de 150 ·10-6 mol/l de DPPH. Denominándose Am (absorbancia de la muestra).
También se colocó en la misma placa de 96 pocillos 20 ul de la solución agua-etanol 50:50 con 180 ml de la solución de 150 ·10-6 mol/l de DPPH. Denominándose Ac (absorbancia control).
En la misma placa de 96 pocillos se colocaron 20 ml de agua con 180 ml de metanol. Denominándose Ab (absorbancia del blanco).
Se llevó la placa al espectrofotómetro Fisher Scientific accuSkan GO, incubándole durante 40 min a temperatura ambiente y leyendo su absorbancia de 515 nm.
Con los resultados obtenidos, se calculó el porcentaje de inhibición del DPPH, establecidos mediante la ecuación IV.

Ecuación IV. Porcentaje de inhibición del DPPH
Donde:
Am= absorbancia de la muestra
Ab= absorbancia del blanco
Ac= absorbancia control
RESULTADOS Y DISCUSIÓN
Caracterización del extracto líquido
Se obtuvieron tres lotes del extracto líquido, en la tabla 1 muestra la eficiencia de extracción, pH, índice de refracción y viscosidad del extracto líquido.
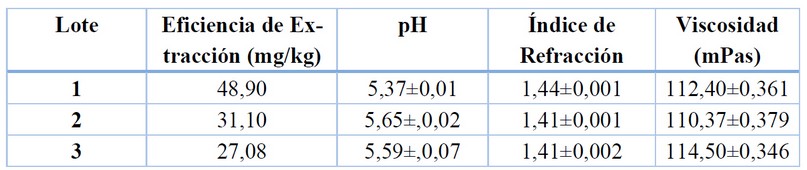
Tabla 1. Caracterización de los extractos líquidos de licopeno
Los resultados de eficiencia de extracción (tabla 1) muestran un promedio de 35,69 mg/kg a partir de cáscara de tomate de árbol, estudios a nivel de banco indican que se obtiene una eficiencia de 34,34 mg/kg 9 lo que demuestra que se obtienen similares resultados, cuando se emplea el mismo proceso de extracción con etanol al 96 %.
Otros estudios muestran una eficiencia de extracción de 559,9 mg de licopeno/kg de pulpa de tomate de árbol 13, este valor más alto se debe a la composición misma de la cáscara la cual contiene menor cantidad de licopeno en comparación con la pulpa de tomate de árbol. En otros trabajos se encontró una eficiencia de extracción de 12,2 mg/kg 11 en cáscaras de tomate de árbol obteniendo una menor eficiencia con respecto a los resultados obtenidos, lo cual indica que la eficiencia de extracción también está relacionada con la variedad de la fruta, época de cosecha y estado de madurez. El estado de madurez influye decisivamente en la composición de carotenoides, existen mayores niveles de carotenoides cuando han sido expuestos en mayor tiempo a la luz del sol y a elevadas temperaturas 13. En lo que se refiere a condiciones de manejo influyen muchísimo el disolvente utilizado y las condiciones de temperatura a la que se realiza la extracción, obteniendo resultados favorables a 50 °C y con etanol al 96 %.
El valor de pH promedio del extracto líquido (tabla 1) obtenido fue de 5,54 a 20 °C, obteniendo un pH ácido, el cual fue influenciado por las características del disolvente, que en este caso fue el etanol. Estudios muestran un pH del extracto de licopeno de 4,68 usando como disolvente ácidos grasos 21. Demostrando así que el pH del extracto tiene una relación directa con el tipo de disolvente que se utiliza en la extracción.
Comparando los resultados obtenidos a nivel industrial con los obtenidos a nivel de laboratorio se encuentran valores similares, obteniendo a nivel de laboratorio un pH desde 5,58 hasta 5,6822.
El índice de refracción del extracto líquido (tabla 1) muestra un promedio de 1,42 a 15 °C, mientras que estudios a nivel de banco muestran para el extracto de licopeno un índice de refracción de 1,363 22; variando un poco el resultado por la temperatura a la que se realizó la medición. El índice de refracción tiene una correlación con la concentración de sólidos y el disolvente, que en este caso fue etanol al 95 %, demostrando así las propiedades activas y la calidad del extracto obtenido 23.
Respecto a la viscosidad (tabla 1) se obtuvo un promedio de 112,42 mPas a 20 °C, estudios con extracto de semilla de mango muestran viscosidades de extractos desde 48 – 115 cP, que es equivalente a mPas 24 encontrándose el valor de viscosidad dentro de este intervalo.
Caracterización del microencapsulado
En la tabla 2 se muestra la concentración del licopeno, eficiencia y humedad del microencapsulado, para los lotes 1, 2 y 3 respectivamente.

Tabla 2. Concentración de licopeno, eficiencia y humedad del microencapsulado
En esta escala (tabla 2) se obtuvo un promedio de concentración de licopeno de 44,07 mg/kg, que comparando con estudios realizados a nivel de banco, en las mismas condiciones, se obtuvo una concentración de licopeno inferior, de 34,34 mg/kg 9.
En lo que se refiere a la eficiencia de microencapsulación (tabla 2), se obtuvo una eficiencia de microencapsulación superior al 90 %, por lo que se considera una eficiencia adecuada, estudios demuestran que la microencapsulación es buena cuando se alcanza una máxima cantidad del material a encapsular dentro de las partículas de polvo, una buena estabilidad de las microcápsulas y prevención de la pérdida de compuestos volátiles (González & Martínez, 2015). Estudios a nivel de laboratorio indican una eficiencia de microencapsulación del 84 % 10 demostrándose que el uso de los polímeros goma arábiga y maltodextrina son eficientes para la microencapsulación.
La humedad de los microencapsulados en polvo (tabla 2) fue aproximadamente de 6,15 %, al comparar con la normativa Ecuatoriana, normas INEN 616 25, se encuentra dentro del valor aceptable de humedad, pues la norma permite un porcentaje máximo de humedad del 14 % y en la farmacopea de los Estados Unidos un máximo del 10 % 26. El valor de humedad tiene un alto impacto en la vida útil del producto, mientras menor es la humedad menor riesgo tiene de contaminación microbiana, la degradación de la pared de la microcápsula, evitando así degradaciones químicas y biológicas 27. Lo que demuestra que el secado por aspersión es un método eficiente para reducir el contenido de agua de los microencapsulados.
Espectroscopía infrarroja de la transformada de Fourier
En la figura 1 se muestra el resultado de la espectroscopia infrarroja de los microencapsulados en los lotes 1,2 y 3, además de un extracto líquido antes de realizar el proceso de microencapsulación.

Figura 1. Espectroscopía infrarroja de la transformada de Fourier de los microencapsulados de licopeno
En lo que respecta a la espectroscopia infrarroja de la transformada de Fourier (figura 1), la banda alrededor de 1000 cm-1 indica en los microencapsulados que el licopeno está enmascarado por la mezcla polimérica, lo que demuestra la efectividad del proceso de microencapsulación, estudios similares muestran la presencia de licopeno en bandas entre los 850 cm-1 y hasta los 1200 cm-1, mientras mayor es la intensidad de la banda, mayor será el contenido de licopeno, siendo los espectros de la transformada de Fourier importantes características de absorción en la región de huellas dactilares con bandas de absorción debidas a vibraciones de deformación carbono-oxígeno 28. Esta banda característica también demuestra que existe presencia de licopeno en el interior de las microcápsulas.
Morfología y aspecto de la superficie de las microcápsulas
En la figura 2 se muestran imágenes de microscopía de barrido electrónico de las microcápsulas de los tres lotes obtenidos.

Figura 2. Fotos de Microscopía de barrido electrónico de los microencapsulados de licopeno (a) Lote 1 con aumento de 516X, (b) Lote 2 con un aumento de 304X y (c) Lote 3 con aumento de 776X.
Las microcápsulas formadas en los 3 lotes, tienen una morfología similar, siendo esféricas las partículas, presentan una superficie exterior redondeada con la formación de concavidades poco homogéneas. La aparición de irregularidades en la superficie, se atribuye a la rápida evaporación del agua durante el proceso de secado por aspersión y ha sido reportado también por otros autores 29,30. También se puede observar la presencia de esferas con superficie lisa, los tamaños de las microcápsulas son del orden de decenas de micrómetros (10 -70 µm), lo que concuerda con el intervalo de tamaños que genera el tipo de atomizador empleado.
Como se aprecia, las superficies externas de las microcápsulas presentan paredes continuas sin fisuras o grietas (figura 3), lo que garantiza la retención del licopeno. En el lado superior izquierdo de la figura 3a se observa una microcápsula fragmentada, donde se evidencia la pared compacta y homogénea generada por el proceso de microencapsulación.

Figura 3. Imágenes de Microscopía de barrido electrónico de los microencapsulados de licopeno (a) Lote 1 con aumento de 516X, (b) Lote 2 con un aumento de 304X
Actividad antioxidante in vivo
La figura 4 muestra el crecimiento de Saccharomyces cerevisiae durante 18 horas, al ser sometida a los diferentes microencapsulados (lote 1, lote 2 y lote 3), control positivo (vitamina C) y control negativo (solo Saccharomyces cerevisiae) y peróxido de hidrógeno con una concentración 0,5 mmol/L.

Figura 4. Curva de crecimiento de Saccharomyces cerevisiae frente al estrés oxidativo de H2O2 con una concentración 0,5 mmol/L
En la figura 4, se observa que en la curva control, el microorganismo tuvo un crecimiento más rápido debido a que no estuvo sometido a ningún estrés.
La curva de peróxido, muestra el crecimiento de Saccharomyces cerevisiae sometida sólo al peróxido de hidrógeno teniendo como resultado el crecimiento más lento de la levadura, debido a que fue sometida al mayor estrés. Resultados similares se encontraron con peróxido de hidrógeno 0,3 mmol/l 31 , investigaciones demuestran que el peróxido produce radicales libres de oxígeno, siendo tóxico para las levaduras, produciendo un estrés oxidativo 32
Los tres lotes tuvieron un crecimiento similar y comparable al control de la vitamina C. Este crecimiento fue igual al de la curva control hasta los 160 min, luego el crecimiento de la levadura disminuyó y se demoró hasta alcanzar la fase estacionaria. La vitamina C es un eficaz antioxidante que favorece el metabolismo de la levadura 33. Demostrando así que la vitamina C, al igual que los microencapsulados tienen propiedades antioxidantes sobre la levadura utilizada en este estudio.
La curva control alcanzó la fase estacionaria a los 440 min, mientras que las curvas con los tres lotes de microencapsulados de licopeno y vitamina C, alcanzaron la fase estacionaria a los 560 min y finalmente la curva que fue con peróxido de hidrógeno tardó más tiempo, alcanzando la fase estacionaria a los 660 min. Esto demuestra que los microencapsulados tienen capacidad antioxidante, corroborando éstos resultados en licopeno de tomate de árbol 34.
Referente a la fase de adaptación tanto los tratamientos que fueron microencapsulados, como control positivo y negativo tardaron 60 min, pero el tratamiento que fue sometido con peróxido tardó en adaptarse 100 min. La variación con respecto al peróxido de hidrógeno se debe, a que éste genera radicales hidroxilos, lo que produce un estrés oxidativo 35.
En la figura 5, se observa el crecimiento de Saccharomyces cerevisiae expuesta a una concentración de peróxido de hidrógeno 5 mmol/l, encontrando en la fase de adaptación de los tres lotes de microencapsulados y el control un tiempo de 60 minutos, existiendo variación con respecto al tiempo en la fase de adaptación en el tratamiento que fue sometido al peróxido de hidrógeno, donde la levadura tardó en adaptarse 100 min. Esta variación se debió a que el peróxido produjo un estrés en las mitocondrias de la levadura 36. Con respecto a la fase de crecimiento, en el tratamiento control tarda 480 minutos en crecer, en cambio en los tres lotes de microencapsulados y vitamina C, tarda 560 min y con el peróxido de hidrógeno tarda 680 min en crecer. Demostrando así la actividad antioxidante que tienen los microencapsulados sobre la levadura.

Figura 5. Curva de crecimiento de Saccharomyces cerevisiae frente al estrés oxidativo de H2O2 con una concentración 5 mmol/L.
Si se comparan los resultados obtenidos en la concentración de peróxido de hidrógeno 0,5 mmol/l con respecto a la gráfica obtenida con una concentración de peróxido de hidrógeno 5 mol/l se aprecia que una mayor concentración, influye en el crecimiento de la levadura, necesitando más tiempo para crecer.
Actividad antioxidante in vitro
En la figura 6, se muestra la curva de calibración de Trolox para la determinación de la actividad antioxidante in vitro del microencapsulado de licopeno, obteniendo un coeficiente de correlación lineal de 0,976, muy cercano a 1, lo que indica que existe una relación directa entre la concentración de trolox y el porcentaje de inhibición.

Figura 6. Curva de calibración de Trolox
La tabla 3. muestra los resultados de inhibición de DPPH de los lotes microencapsulados. La técnica del DPPH (1,1 difenil-2picril-hidrazilo), se usa para evaluar la capacidad antioxidante de alimentos, este método se fundamenta en que el DPPH es un radical libre que al juntarse con el antioxidante produce una reacción redox de primer orden 37,38. Consiguiendo similares resultados con el microencapsulado de licopeno, tanto a escala de banco con un equivalente a trolox de 142,72 µmoll-1 9 como a nivel industrial, lo que demuestra que la tecnología usada para la microencapsulación de licopeno a partir de las cáscaras de tomate de árbol, es altamente efectiva.

Tabla 3. Resultados de inhibición por DPPH de los lotes de microencapsulado
CONCLUSIONES
Se concluye que el método de microencapsulación empleado para el licopeno es efectivo para ser usada a nivel industrial, generando una elevada eficiencia de microencapsulación, siendo una tecnología que puede ser implementada en la industria para el aprovechamiento de los desechos agroindustriales de la cáscara de tomate de árbol, brindando beneficios para la salud de las personas por sus características antioxidantes.
Se caracterizó fisicoquímicamente el ingrediente bioactivo licopeno, encontrando en el extracto líquido un pH de 5,54 a 20 °C, obteniendo un pH ácido, el cual fue influenciado por las características del disolvente, que en este caso fue el etanol, un índice de refracción de aproximadamente 1,42 el cual tiene una relación directa con la concentración de sólidos, además del disolvente y una viscosidad de 112,42 mPas, en lo que se refiere al microencapsulado se obtuvo una humedad del 6,15 % siendo un valor que garantizará en el tiempo de la vida útil del producto, encontrándose acorde a la farmacopea de los Estados Unidos. Con respecto a la espectroscopía infrarroja de la transformada de Fourier, se evidencia que en los microencapsulados el licopeno está protegido por la mezcla polimérica, lo que demuestra la eficiencia del proceso de microencapsulación. Se obtuvieron microcápsulas con forma esfeérica, superficie lisa lo cual es de gran importancia también para la vida útil del producto.
Se demostró la capacidad antioxidante in vivo de los microencapsulados, en Saccharomyces cerevisiae, encontrándose que tienen una actividad antioxidante similar a la de la vitamina C. También se evaluó la capacidad antioxidante in vitro mediante el método del DPPH, encontrando un equivalente de trolox de 192,50 µmoll-1, 123,53 µmoll-1 y 139,51 µmoll-1 en los tres lotes y respectivamente con un porcentaje de inhibición del 48,03 %, 35,07 % y 38,07 %.
.
Financiamiento: Este trabajo no recibió financiamiento externo.
Declaración de la Junta de Revisión Institucional: No aplicable
Informed Consent Statement: No applicable
Declaración de disponibilidad de datos: Trabajo inédito.
Agradecimientos: A la Agencia Española de Cooperación Internacional para el Desarrollo (AECID) y a la empresa Andes Kinkuna S.A.
Conflictos de interés: “Los autores declaran no tener conflicto de interés”.
REFERENCES
1. Pataro, G., Carullo, D., Falcone, M. & Ferrari, G. Recovery of lycopene from industrially derived tomato processing by-products by pulsed electric fields-assisted extraction. Innov. Food Sci. Emerg. Technol. 63, 102369 (2020).
2. Martínez-Navarrete, N., del Mar Camacho Vidal, M. & José Martínez Lahuerta, J. Los compuestos bioactivos de las frutas y sus efectos en la salud. Act. Diet. 12, 64-68 (2008).
3. Reyna, M., Bojórquez, C., González, J. & Sánchez, P. Propiedades funcionales y beneficios para la salud del licopeno. Nutr. Hosp. 28, 6-15 (2013).
4. Salazar-lugo, R., Barahona, A., Ortiz, K., Chávez, C. & Freire, P. Efecto del consumo de jugo de tomate de árbol ( Cyphomandra betacea ) sobre el perfil lipídico y las concentraciones de glucosa en adultos con hiperlipidemia , Ecuador . Arch. Latinoam. nitrición 66, 121-127 (2016).
5. Tan, S. et al. Lycopene, polyphenols and antioxidant activities of three characteristic tomato cultivars subjectes to two drying methods. Food Chem. 338, (2020).
6. Lorenzo Fuentes, J. Las plantas como fuente de compuestos fotoprotectores frente al daño en el ADN producido por la radiación ultravioleta. Ciencias la Tierra 43, 550-562 (2019).
7. Periago, M. J., Martínez-valverde, I. & Ros, G. Propiedades biologicas y valor nutritivo del licopeno. Ant. Vet, 66, 51-66 (2001).
8. González, E. & Martínez, O. Microencapsulación mediante secado por aspersión de compuestos bioactivos. Rev. Iberoam. Tecnol. Postcosecha 162, 180-192 (2015).
9. Urbina, W., Fernández, D., López, O. & Iraizoz, A. Obtención de un extracto rico en carotenoides con capacidad antioxidante a escala de banco a partir de residuos agroindustriales de tomate de árbol (Solanum betaceum). Rev. Bionatura 5, 1356-1362 (2020).
10. Perez, C. & Fernandez, D. Extracción y microencapsulación de licopenos provenientes de residuos agroindustriales del tomate de árbol (Solanum betaceum). (Tesis de prefrado (Universidad Técnica de Ambato), 2019).
11. Candelas, M., Alanis, M. & Río, F. Lycopene measurement and other carotenoids in tomato and tomato powder . Rev. Mex. Agronegocios X, 1-13 (2006).
12. Shu, B., Yu, W., Zhao, Y. & Liu, X. Study on microencapsulation of lycopene by spray-drying. J. Food Eng. 76, 664-669 (2006).
13. Cardona, E. & Rios, L. Extraction of the carotenoid lycopene from chonto tomato (lycopersicum esculentum). Vitae 13, 44-53 (2006).
14. Strati, I. F. & Oreopoulou, V. Effect of extraction parameters on the carotenoid recovery from tomato waste. Int. J. Food Sci. Technol. 46, 23-29 (2011).
15. Strati, I. & Oreopoulou, V. Process optimisation for recovery of carotenoids from tomato waste. Food Chem. 129, 747-752 (2011).
16. Pérez, C. & Fernández, D. Extracción y microencapsulación de licopenos provenientes de residuos agroindustriales del tomate de árbol (Solanum betaceum). ((tesis de pregrado) Universidad Técnica de Ambato, 2019).
17. Cromer, A. H. & Fernández, J. Física en la ciencia y en la industria. (Reverté, 1998).
18. Peláez, P. & Montoya, P. Validación funcional de extractos polifenólicos de cacao mediante ensayos in vivo con organismos modelo. ((Tesis Doctoral) Universidad de Valencia, 2016).
19. Calle, D. & López, D. Extracción y microencapsulación de carotenoides de chonta (Bactris gasipaes). (Técnica de Ambato, 2020).
20. Bobo-García, G. et al. Intra-laboratory validation of microplate methods for total phenolic content and antioxidant activity on polyphenolic extracts, and comparison with conventional spectrophotometric methods. J. Sci. Food Agric. 95, 204-209 (2015).
21. Delgado, L. & Mallama, C. Evaluación del extracto de licopeno partiendo de residuos de diferentes frutas y hortalizas, aplicado en un producto cosmético. Fundación Universidad de América vol. 8 (2019).
22. Urbina, W. Obtención de un extracto rico en carotenoides con capacidad antioxidante a escala de banco a partir de residuos agroindustriales de tomate de árbol (Solanum betaceum). Universidad Técnica de Ambato (Universidad Técnica de Ambato, 2019).
23. Zhao, H. et al. The evaluation and selection of core materials for microencapsulation: A case study with fragrances. Flavour Fragr. J. 36, 652-661 (2021).
24. Maisuthisakul, P. & Gordon, M. H. Influence of polysaccharides and storage during processing on the properties of mango seed kernel extract (microencapsulation). Food Chem. 134, 1453-1460 (2012).
25. NTE. Instituto Ecuatoriano de Normalizacion. Instituto Ecuatoriano de Normalización 21 (2015).
26. Pharmacopoeia of United States USP, N. Reference Standards of Dietary Supplements and Herbal Medicines. https://store.usp.org/product/1370881#ads (2018).
27. Esquivel-González, B., Martínez-L, O. & Rutiaga-Quiñones, O. Microencapsulación mediante secado por aspersión de compuestos bioactivos. Rev. Iberoam. Tecnol. Postcosecha 16, 180-192 (2015).
28. Bunghez, I. R., Raduly, M., Doncea, S., Aksahin, I. & Ion, R. M. Lycopene determination in tomatoes by different spectral techniques (UV-VIS, FTIR and HPLC). Dig. J. Nanomater. Biostructures 6, 1349-1356 (2011).
29. Rosenberg, M., Talmon, Y., Kopelman, I. J. A scanning electron microscopy study of microencapsulation. Food Sci. 50, 139-144 (1985).
30. Buffo, R. A., Probst, K., Zehentbauer, G., Luo, Z. & Reineccius, G. A. Effects of agglomeration on the properties of spray-dried encapsulated flavours. Flavour Fragr. J. 17, 292-299 (2002).
31. Proaño, J. & Fernández Rivero, D. Extracción asistida por ultrasonido de licopenos provenientes de residuos agroindustriales de tomate de árbol (Solanum betaceum Cav.) con capacidad antioxidante. (Universidad Técnica de Ambato, 2021).
32. Folch-Mallol, L., Garay-Arroyo, J., Lledías, A. & Covarrubias Robles, F. La respuesta a estrés en la levadura Saccharomyces cerevisiae. Rev. Latinoam. Microbiol. 46, 24-45 (2004).
33. Saffi, J., Sonego, L., Varela, Q. D. & Salvador, M. Antioxidant activity of L-ascorbic acid in wild-type and superoxide dismutase deficient strains of Saccharomyces cerevisiae. Redox Rep. 11, 179-184 (2006).
34. Pazmiño, D. & Rivero Fernández, D. APROBACIÓN DEL TUTOR. (Universidad Técnica de Ambato, 2019).
35. Macedo-Marquez, A. Tip Revista Especializada en Ciencias. Tip Rev. Espec. en Ciencias Químico-Biológicas 15, 97-103 (2012).
36. Vargas, V. Avances en Química Universidad de los Andes. 2, 3-15 (2007).
37. Guija-Poma, E., Inocente-Camones, M., Ponce-Pardo, J. & Zarzosa-Norabuena, E. Evaluación de la técnica 2,2-Difenil-1-Picrilhidrazilo (DPPH) para determinar capacidad antioxidante. Horiz. Médico 15, 57-60 (2015).
38. Coba, P., Mayacu-Tivi, L. & Vidari, G. Importancia de la actividad antioxidante y evaluación de extractos en etanol del género Oryctanthus. La Granja. Rev. Ciencias la vida 11, 22-30 (2010).
Received: 26 December 2022 / Accepted: 15 March 2023 / Published:15 June 2023
Citation: Pazmiño Miranda, P.; Fernández, D.; Coello-Fiallos, D.; López,D.; Airaizoz, A. Microencapsulación de licopeno extr . Revis Bionatura 2023;8 (2) 3. http://dx.doi.org/10.21931/RB/2023.08.02.3



















