Vol 8 No 1 2023 – 22

Identificación de hongos filamentosos asociados al suelo del bosque protegido de Prosperina
Identification of filamentous fungi associated with the soil of the Prosperina Protected forest
Carreño-Bulgarin Gladys Paola 2, Quijije-Franco Genny 2 , Diaz Byron1 , Maridueña-Zavala Maria Gabriela1
, Maridueña-Zavala Maria Gabriela1 and Cevallos-Cevallos Juan Manuel1,2*
and Cevallos-Cevallos Juan Manuel1,2*
 , Maridueña-Zavala Maria Gabriela1
, Maridueña-Zavala Maria Gabriela1 and Cevallos-Cevallos Juan Manuel1,2*
and Cevallos-Cevallos Juan Manuel1,2*
1 Escuela Superior Politécnica del Litoral, ESPOL, Centro de Investigaciones Biotecnológicas del Ecuador, CIBE, Campus Gustavo Galindo Km 30.5 Vía Perimetral, P.O Box 09-01-5863, Guayaquil, Ecuador;
2 Escuela Superior Politécnica del Litoral, ESPOL, Facultad de Ciencias de la Vida, FCV, Campus Gustavo Galindo Km 30.5 Vía Perimetral, P.O Box 09-01-5863, Guayaquil, Ecuador; pcalle@espol.edu.ec
* Correspondence: jmceva@espol.edu.ec
Available from: http://dx.doi.org/10.21931/RB/2023.08.01.22
RESUMEN
El Bosque de Prosperina es un área protegida ubicada en la ciudad de Guayaquil-Ecuador donde existe una gran diversidad de plantas, animales y, últimamente, microorganismos que contribuyen a su conservación y mantenimiento. Las muestras de suelo recogidas en las estaciones de Cuevas, Cañas y FCV durante la estación seca se analizaron mediante métodos microbiológicos convencionales. Como resultado, se identificaron 38 especies, y en cada estación se obtuvieron 16, 16 y 16, respectivamente. Los géneros más frecuentes encontrados en las tres estaciones son Aspergillus, Penicillium, Trichoderma y Absidia, con menor frecuencia Fusarium, Cladosporium, Talaromyces, Cur-vularia, Humicola, Gongronella, Clonostachys y Mariannea. Se crioconservaron 38 cepas de hongos filamentosos en la Colección de Cultivos de microorganismos del CIBE (CCM-CIBE), de las cuales 36 eran especies únicas. Los resultados obtenidos sugieren que las especies encontradas. Su desplazamiento puede verse afectado por factores naturales y humanos. Además, confirmamos microorganismos biocontroladores como Purpureocillium, un nematófago y Cladosporium que, pueden tener un alto potencial en actividades de biorremediación de im-portancia para la agricultura y recuperación de suelos, lo que corrobora que el Bosque de Protección es una rica fuente de microorganismos con una gran reputación para su conservación.
Palabras clave: Bosque Protector, microdiversidad del suelo, biocontrol, conservación.
ABSTRACT
The Prosperina Forest is a protected area located in the city of Guayaquil-Ecuador where there is a great diversity of plants, animals and, lately, microorganisms that contribute to its conservation and maintenance. Soil samples collected at the Cuevas, Cañas and FCV stations during the dry season were analyzed by conventional microbiology methods. As a result, 38 species were identified in each station 16, 16 and 16 were obtained, respectively. The most frequent genera found in the three stations are Aspergillus, Penicillium, Trichoderma and Absidia, with less frequency Fusarium, Cladosporium, Talaromyces, Curvularia, Humicola, Gongronella, Clonostachys and Mariannea. Thirty-eight strains of filamentous fungi were cryopreserved in the CIBE Culture Collection of microorganisms (CCM-CIBE), of which 36 were unique species. The results obtained suggest that the species found. Their displacement can be affected by natural and human factors. In addition, we confirm biocontrol microorganism as Purpureocillium, a nematophagous and Cladosporium that, may have a high potential in bioremediation activities of importance for agriculture and soil recovery, which corroborates that the Protected Forest is a rich source of microorganisms with a great reputation for its conservation.
Keywords: Protected forest, soil microdiversity, biocontrol, conservation.
INTRODUCCIÓN
El Bosque protector “Prosperina” (BPP) categorizado como Área de bosque y vegetación protegida desde el 29 de junio de 1994, mediante acuerdo Ministerial N°23 publicada en el registro oficial No. 472, Acuerdo Ministerial No. 144 del Ministerio del Ambiente se encuentra ubicado al oeste del Ecuador en el Campus “Gustavo Galindo” de la Escuela Superior Politécnica del Litoral en la ciudad de Guayaquil, provincia del Guayas y es considerado una zona de reserva que alberga diversas especies de fauna y flora sujeta a investigación por parte de la comunidad científica.1 El BPP se encuentra rodeada por 5 cuencas hidrográficas y forma parte de la cordillera Chongón Colonche.2 Además, estos ecosistemas presentan un clima cálido, con temperaturas que oscilan entre 23 – 27 ºC, lo que coloca al BPP en la categoría de Bosque Seco Tropical, según el criterio de la propuesta preliminar de un sistema de clasificación de vegetación para el Ecuador continental de 1999.3
Esto significa que el BPP es un área estratégica para la conservación de la biodiversidad biológica ya que poseen árboles nativos caducifolios dadas las dos temporadas seca y lluviosa en la región, 4 el BPP realiza programas de protección y concienciación en la conservación de las especies, además busca la valoración de los recursos ambientales mediante visitas y difusión de las principales especies de flora y fauna que habitan en el bosque seco. Cerca de sus 332,3 has de bosques en un clima seco tropical favorece el crecimiento de microbiota de suelo rica en consorcios de hongos, como micorrízicos, ectomicorrízicos, micorrízicos arbusculares, patógenos, bacterias y levaduras. 5
El potencial microbiano del BPP puede ser aprovechado para el desarrollo de productos a bases de micotoxinas que pueden actuar como biocontroladores de fitopatógenos en alimentos, también contribuyen en la regeneración de suelos maltratados en la que necesitan incorporarse microorganismos presentes en la materia orgánica de bosques a través de la elaboración de compost. 6,7 Adicionalmente, los hongos filamentosos pueden ser empleados en la biotecnología fúngica porque permiten fomentar la economía circular, mitigar el cambio climático y generar la producción sostenible de alimentos, combustibles, textiles, fármacos, entre otros. 8
Dentro de la microdiversidad que se encuentran en los suelos de bosque podemos encontrar los filo Ascomycota y Basidiomycota, los cuales predominan a escala mundial en los ecosistemas forestales gracias a las condiciones climáticas que permiten su crecimiento,9 tal es así como en el agroecosistema K’iphak’iphani en Bolivia predominan de la división Ascomycota los géneros Penicillium, Alternaria, Rhizopus, Mucor, Fusarium y Trichoderma 10 algunos con potencial de biorremediación debido a su eficiencia en la degradación de hidrocarburos de petróleo.11
Según reportes, en el Ecuador entre los géneros de hongos filamentosos representativos de suelos de zonas forestales se encuentran Aspergillus, Penicillium y Trichoderma los cuales variaban según el tipo de suelo.12 Así también en el Bosque Protector Aguarongo, se han encontrado los hongos de los Géneros Aspergillus, Trichoderma y Fusarium.13 En la región costa se han realizado estudios sobre la diversidad de hongos micorrízicos arbusculares asociados a plantas de cacao que dependen de estos microorganismos para realizar procesos fisiológicos y desarrollar resiliencia al cambio global.14 No obstante, en el Bosque Protector La Prosperina son pocos los estudios que se han realizado en plantas, pero no contemplan estudios de biodiversidad de hongos filamentosos por lo que es muy importante explorar la biodiversidad microbiana de nuestros bosques que nos ayude a desarrollar técnicas de control microbianas para el control de patógenos en el campo. En función a ello, surge la necesidad de determinar la biodiversidad de hongos filamentosos asociados al suelo del Bosque Protector la Prosperina a través de métodos moleculares y posterior conservación de los mismos.
MATERIALES Y MÉTODOS
Zonas de muestreo
Para el muestreo fueron identificadas tres estaciones en la superficie del Bosque Protector La Prosperina: E1) Albarrada Cuevas; E2) Albarrada Cuevas y E3) zona cercana a la Facultad de Ciencias de la Vida en la ESPOL (FCV).
La Estación 1 correspondiente a la “Albarrada Cuevas” se encuentra ubicada a 127 msnm en el núcleo 1 del BPP, específicamente en las coordenadas 2°9’23’’S y 79°57’47’’W. Posee una alta densidad de especies vegetales herbáceas, especies arbóreas caducifolias que desarrollan hojas al empezar la temporada lluviosa.
La estación 2 correspondiente a la “Albarrada Cañas” que se ubica en el núcleo 1 del BPP a una altitud de 211msnm y sus coordenadas son 2°9’26’’S y 79°57’56’’W. Posee una alta densidad de plantas pteridofitas y gramíneas que permanecen con hojas durante todo su ciclo de vida. Dentro de la zona se registró la presencia de anfibios (Epipedobates machalilla) y mamíferos como el oso hormiguero Tamandua tetradactyla.
La estación 3 corresponde a la FCV y se ubica en la zona de protección permanente del BPP, cerca de la Facultad de Ciencias de la Vida (FCV) de la Escuela Superior Politécnica del Litoral (ESPOL). Se encuentra a una altitud de 80 msnm específicamente en las coordenadas 2°9’10’’S y 79°56’23’’W. El suelo es más compacto que en las otras estaciones y en sus alrededores se encuentra una alta densidad de especies arbóreas y se registra la presencia de diversos grupos de aves y murciélagos.
Recolección de muestras
La recolección de muestras se realizó a una profundidad a 25 cm siguiendo metodología consultada,15 en el que se empleó extractor de núcleos para suelos. En cada estación (E1; E2; E3) se recolectaron 3 réplicas (R1; R2; R3) con equidistancia de 5 metros. Se pesaron 100 g de suelo por réplica y se almacenaron en bolsas plásticas con cierre hermético, previamente esterilizadas con radiación UV, seguido las muestras fueron trasladadas en una nevera portátil el mismo día para su siembra en el laboratorio de Fitopatología del CIBE.
Aislamiento de hongos filamentosos
Para el aislamiento de los hongos se realizaron diluciones seriadas, en las que 10g de suelo por réplica se disolvieron en 90 ml de agua peptonada estéril (10-1), se homogenizó la solución y se dejó reposar durante 5 minutos para que los sólidos decantaran. Seguido a esto, se dispensó una alícuota de 1 ml de la solución de suelo en un tubo Falcón que contenía 9 ml de agua peptonada, se agitó usando el vortex y se continuó con el mismo procedimiento hasta conseguir una dilución de 10-4. Luego, 2 réplicas por muestras fueron sembradas usando el método de esparcido, en la que 1 ml de cada solución fue esparcido con la ayuda de un asa de Drigalsky en caja petri que contenía medio Agar Papa Dextrosa (PDA), preparado con cloranfenicol (400 ppm). Las muestras fueron incubadas a 25 °C por 7 días y revisadas cada 24 horas para el control de crecimiento y conteo utilizando un estereoscopio BOECO modelo BTB-A. Seguido, las cepas fueron purificadas, trasladando los micelios que estaban creciendo en cajas con medio PDA y cloranfenicol. Una vez que las cepas estaban puras se procedió a la obtención de cultivos monospóricos siguiendo los protocolos previamente reportados.16 Brevemente, se realizó una solución de esporas en 2 ml de agua estéril, lugo se dispensaron 10 µl de la solución en cajas con medio PDA y se incubó hasta que se observó crecimiento micelial. Luego, con ayuda del bisturí se cortaron secciones de medio donde se encontraban secciones de hifas puras para luego trasladarlas a un nuevo medio y esperar el crecimiento final de micelio para extracción de ADN.
Extracción y amplificación de muestras de ADN
Los cultivos monospóricos fueron utilizados para la extracción de DNA siguiendo el protocolo de extracción de hongos filamentosos reportado en previos estudios.17 Brevemente, los que a una pequeña porción de micelio se le agregaron 30 µl de NaOH 0,5 M. Luego, se trituró el micelio y se dejó reposar durante 10 minutos. A continuación, a cada tubo se agregaron 150 µl de una solución Tris HCL 100 mM + EDTA 0.5 M, con un pH de 8, seguido de un choque térmico a 95 °C durante 10 minutos. Finalmente, las muestras se centrifugaron durante 5 min a 15000 rpm. Para la amplificación de la región ITS (Internal transcribed spacer) y LSU (Large Subunit) se utilizaron los cebadore ITS1-F (5’CTTGGTCATTTAGAGGAAGTAA3’) e ITS4 (5’TCCTCCGCTTATTGATATGC3’), mientras que para LSU se emplearon: LROR (5’ACCCGCTGAACTTAAGC3’) y LR5 (5’TCCTGAGGGAAACTTCG3’).18 Las reacciones de PCR se realizaron con un volumen final de 32 µl compuesto por: 12,72 µl de H2O ultrapura, 16µl de 1X Taq polimerasa, 0,64 µl de cada cebador 0,2 µM y 2 µl de ADN. Las condiciones de amplificación consistieron en una desnaturalización a 95°C durante 10 min, seguido de 35 ciclos de 1 min a 94°C, 2 min a 63 °C y 2 min a 72°C, en base al protocolo.19 Los amplicones obtenidos fueron separados por electroforesis en gel de agarosa al 2% que se tiñó con SYBR- Safe DNA gel stain. El tamaño de los fragmentos fue verificado por comparación con el marcador de peso molecular correspon diente a 1000 pares de bases. Las condiciones en las que se corrió el gel fueron a 150 V durante 40 minutos. Posteriormente el gel se observó con la ayuda de un transiluminador (trans-UV y epi-white) con Image Lab™ Software, BIO-RAD. Finalmente se cuantificaron los productos de PCR en el NanoDrop 2000c y se enviaron a Macrogen para la secuenciación de las muestras.
Identificación de especies
Para la limpieza de las secuencias se eliminaron los nucleótidos de baja calidad de los extremos de cada secuencia aplicando el software Geneious.20 Adicionalmente, se descartaron aquellas secuencias con menos de 400 pb. Se realizó la comparación de las secuencias de ADN procesadas con la base de datos de GenBank, mediante Blastn y Blastx (http://www.ncbi.nlm. nih.gov/BLAST). Empleando Geneious, para cada secuencia se obtuvieron los primeros 10 hits considerando que exista un porcentaje de identidad mayor al 98% de acuerdo a lo estipulado para el análisis de unidades taxonómicas operativas empleando las regiones ITS y LSU.21 Posteriormente, se realizó la selección de secuencias considerando el porcentaje de identidad, el número de gaps, el E-value, la longitud de la secuencia, entre otros. Con el listado de secuencias seleccionadas, se elaboró un listado de las especies identificadas con su respectivo código de acceso a la base de datos de GenBank, paso seguido usando el método Maximun Likelihood se diseñaron arboles filogenéticos para identificar la relación evolutiva entre las especies asociadas al suelo del BPP utilizando el software Mega X.22
Crioconservación de especies
Para la preservación de los microorganismos obtenidos se siguió el protocolo de conservación empleado en la Colección de Cultivos Microbianos del CIBE.23 Los procedimientos para el depósito de cepas en la Colección fueron en base a los protocolos internos del Plan de Manejo de microorganismos de la colección. Para garantizar una buena conservación del microorganismo se emplearon cajas Petri con medios PDA con antibiótico en la que el microorganismo se encontraba joven, pero con cuerpos fructíferos de ser el caso, en caso de que el microorganismo solo presentara micelio se debe esperar que esté al menos con un 80% de crecimiento en placa Petri. Una vez alcanzado el tiempo de crecimiento se realiza la conservación manteniendo 5 tubos criogénicos con medio PDB (Potato dextrosa Broth) y Glicerol para el método de crioconservación, 3 tubos de borosilicato con tapa con medio PDA para el método de aceite mineral y 3 tubos criogénicos con agua para la conservación en agua.
RESULTADOS Y DISCUSIÓN
Identificacion de hongos del BPP
En total se obtuvieron 64 aislados de las tres estaciones recolectadas, de la cuales se contabilizaron un total de 38 especies únicas de hongos filamentosos asociados al suelo del BPP. En la estación Cuevas se encontraron 20 aislados, en la Tabla 1 se puede apreciar el listado de cepas identificadas de la estación Cuevas mediante técnicas moleculares con sus respectivos porcentajes de identidad y códigos de acceso para cada cepa. Además, se puede observar los rasgos morfológicos de las cepas en la Figura 1, en esta área predomina el género Aspergillus, seguido de Penicillium.
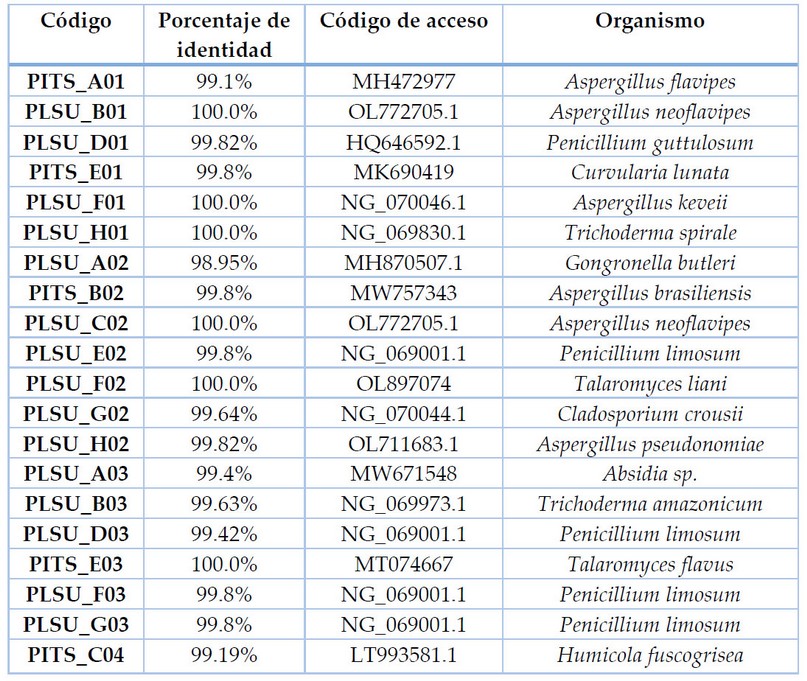
Tabla 1. Especies identificadas en la Estación Cuevas (E1).
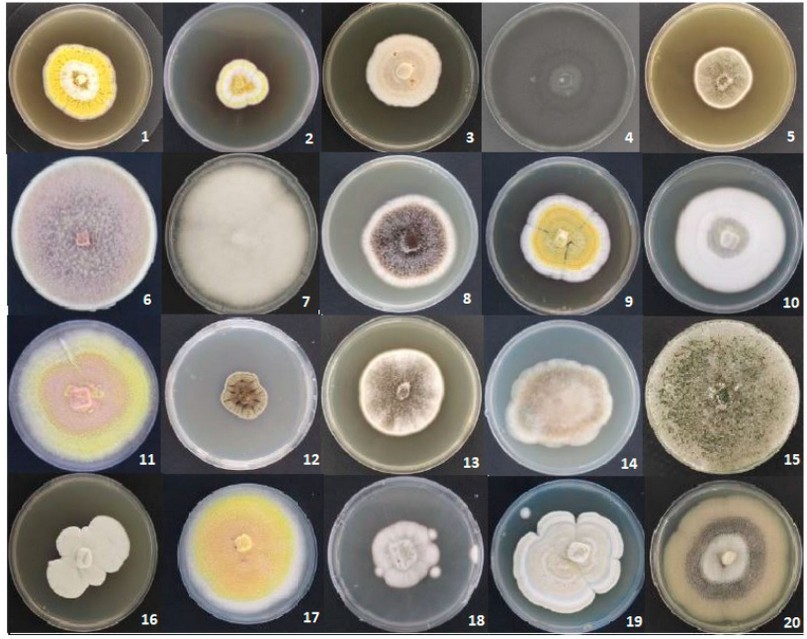
Figura 1. Diversidad de hongos de la Estación 1, Aspergillus flavipes (1), Aspergillus neoflavipes(2), Penicillium guttulosum(3), Curvularia lunata(4), Aspergillus keveii(5), Trichoderma spirale(6), Gongronella butleri(7), Aspergillus brasiliensis(8), Aspergillus neoflavipes(9), Penicillium limosum(10), Talaromyces liani(11), Cladosporium crousii(12), Aspergillus pseudonomiae(13), Absidia sp.(14), Trichoderma amazonicum(15), Penicillium limosum(16), Talaromyces flavus(17), Penicillium limosum(18), Penicillium limosum(19), Humicola fuscogrisea(20).
En la estación Cañas se identificaron 26 cepas, en la Tabla 2 se observa el listado de las cepas identificadas de esta estación por técnicas moleculares junto con su porcentaje de identidad se puede observar también que por la frecuencia de aparición predomina el género Trichoderma, seguido de Penicillium. En la Figura 2 se puede apreciar la morfología de cada cepa identificada.
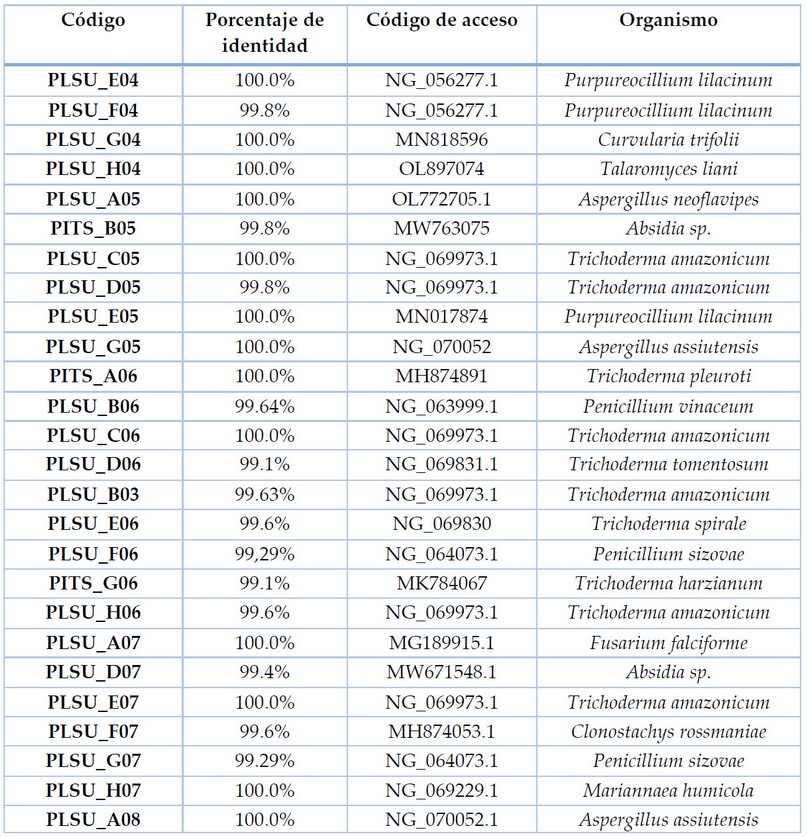
Tabla 2. Especies identificadas en la Estación Cañas (E2).
Figura 2.- Diversidad de hongos de la Estación 2. Purpureocillium lilacinum (1), Purpureocillium lilacinum(2), Curvularia trifolii(3), Talaromyces liani(4), Aspergillus neoflavipes(5), Absidia sp.(6), Trichoderma amazonicum(7), Trichoderma amazonicum(8), Purpureocillium lilacinum(9), Aspergillus assiutensis(10), Trichoderma pleuroti(11), Penicillium vinaceum(12), Trichoderma amazonicum(13), Trichoderma tomentosum(14), Trichoderma amazonicum(15), Trichoderma spirale(16), Penicillium sizovae(17), Trichoderma harzianum(18), Trichoderma amazonicum (19), Fusarium falciforme (20), Absidia sp.(21), Trichoderma amazonicum(22), Clonostachys rossmaniae(23), Penicillium sizovae (24), Mariannaea humícola (25).
Finalmente, la estación FCV presentó un total de 18 cepas en total, en la Tabla 3 se puede apreciar el listado de los hongos identificados en esta estación junto con su porcentaje de identidad y en la Figura 3 se observa las características morfológicas de los hongos. De acuerdo con la información obtenida se puede determinar que los géneros que más predominan en esta zona son Penicillium y Aspergillus.

Tabla 3.- Especies identificadas en la estación FCV (E3).
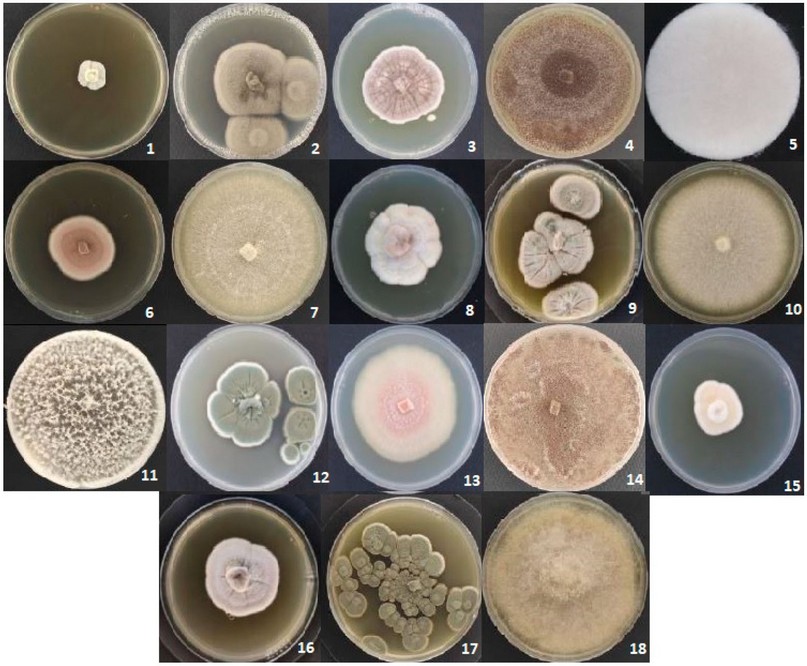
Figura 3. Diversidad de hongos de la Estación 3. Penicillium rubidurum (1), Cladosporium cladosporioides(2), Aspergillus keveii(3), Aspergillus aculeatus(4), Cunninghamella echinulata(5), Purpureocillium sp(6), Fusarium falciforme(7), Penicillium vinaceum(8), Penicillium shearii(9), Fusarium solani(10), Trichoderma erinaceum(11), Penicillium steckii(12) Aspergillus aculeatus (13), Penicillium vinaceum(14), Penicillium vinaceum(15), Penicillium citrinum(15), Absidia caatinguensis(16).
Con la información de los datos de frecuencias obtenidas de los hongos en cada sitio de recolección se realizó un análisis de los géneros únicos identificados con su respectiva frecuencia por estación. Los principales géneros fueron Penicillium, Aspergillus y Trichoderma en el BPP. En la Figura 4 se puede observar la frecuencia de aparición por cada género encontrado, es así que para la Estación Cuevas se encontró una mayor abundancia de Aspergillus, Penicillium, Trichoderma y Talaromyces mientras que otros géneros con menor frecuencia fueron Absidia, Cladosporium, Curvularia, Gongronella y Humicola. Por otra parte, en la Estación Cañas además de Trichoderma, Aspergillus y Penicillium se presentaron especies de Talaromyces, Absidia, Fusarium, Purpureocillium, Curvularia, Clonostachys y Mariannaea con menor frecuencia. Por último, la Estación FCV estuvo dominada por Penicillium, Aspergillus y Fusarium, y en menor proporción se encontraron especies de Trichoderma, Absidia, Purpureocillium, Cladosporium y Cunninghamella.
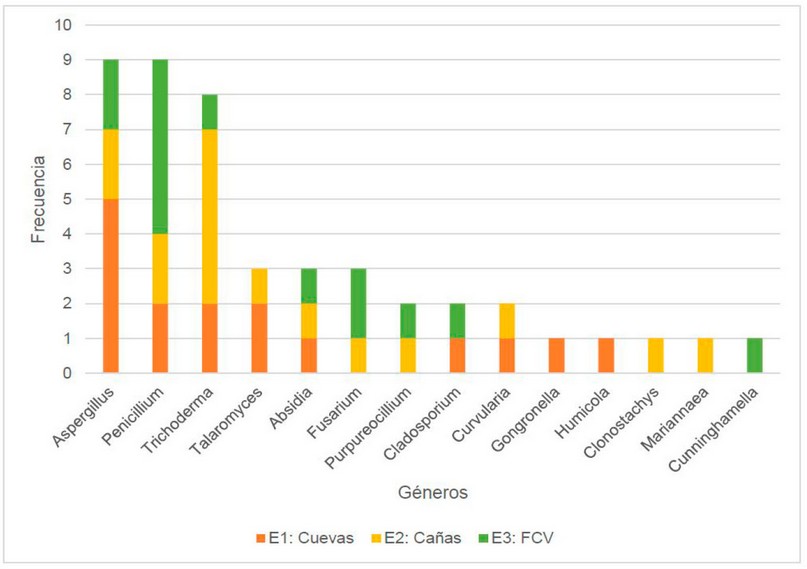
Figura 4. Frecuencia de hongos por estación.
Según lo que se observa las tres estaciones varían muy poco en la clasificación de géneros encontrados, gracias a su cosmopolita distribución y siendo que están en una posición geográfica muy cercana, la poca variación observada en su micro diversidad puede sugerirse que es debido a características del suelo, factores ambientales, la presencia de agua o factores humanos,24 lo que hace que muchos de ellos presenten características dominantes a estos factores adversos.25 El género Trichoderma es considerado una especie muy importante debido a su potencial microbiológico que permite ser evaluado frente a otros microorganismos no benéficos gracias a su poder inhibitorio, además de su buen metabolismo puede soportar diversas condiciones ambientales lo que lo categoriza como una especie dominante para muchos de los suelos forestales y agrícolas,26–28 sus beneficios también incluyen a la planta cuándo se ha convertido en unos de sus principales hospederos.29 Por otro lado, el género Penicillium conocido comúnmente por hallarse cerca de materia saprófita es considerado uno de los mayores promotores de crecimiento y fertilidad de suelos, ya que genera metabolitos secundarios que pueden promover el crecimiento de las plantas convirtiéndose en una fuente soluciones para la agricultura 30 y el género Aspergillius considerado una especie productora de anflotoxinas, también es reconocida por tener acción antiviral, antibacteria, antifungal.31
Finalmente, géneros en menor proporción como curvularia, fusarium consideradas especies dominantes al encontrarse en muchos sutratos y en suelos agrícolas pueden llegar a ser desde hongos endófitos hasta patógenos de plantas o suelos en descomposición,32,33 también el género Purpureocillium algunos como patógenos de nemátodos pueden actuar produciendo metabolitos tóxicos entre otros,34 el género Cladosporium es que ha sido considerado como mohos de interiores y exteriores, también se han podido encontrar que algunas especies pueden compartir características de endófitos hasta propiedades de biorremediación.35 Así también, los géneros Cunninghamella, Clamadomices y Absidia del género mucorales que pueden ser oportunistas y causar afectaciones en la salud humana,36 Clonostachys estudiados como posibles agentes de control biológico.37 En general, los hongos encontrados, aunque en menor proporción sugiere la posibilidad de incorporarlos en pruebas de control biológico para la búsqueda de nuevos inhibidores para el control de plagas.
Arboles filogenéticos
Con la ayuda del programa MEGA y de un análisis Maximun Likelihood, se obtuvo el árbol filogenético de las secuencias analizados. A partir de las especies únicas identificadas, se realizó el estudio de la relación filogenética según de acuerdo a la región ITS y LSU lo que se observa en la Figura 5. Como se puede observar, los géneros con mayor relación evolutiva fueron Aspergillus y Talaromyces. Asimismo, Fusarium y Trichoderma se mantuvieron con estrecha cercanía mientras que Penicillium, Cladosporium y Curvularia estuvieron como taxones aislados. Además, es necesario notar que aquellas especies con el mismo género o con cercanía evolutiva poseen morfologías y tonalidades similares en su micelio aéreo. Como se puede observar, los géneros con mayor relación evolutiva fueron Trichoderma, Aspergillus y Penicillium. Por otro lado, Humicola, Absidia y Cladosporium se presentaron como taxones aislados.
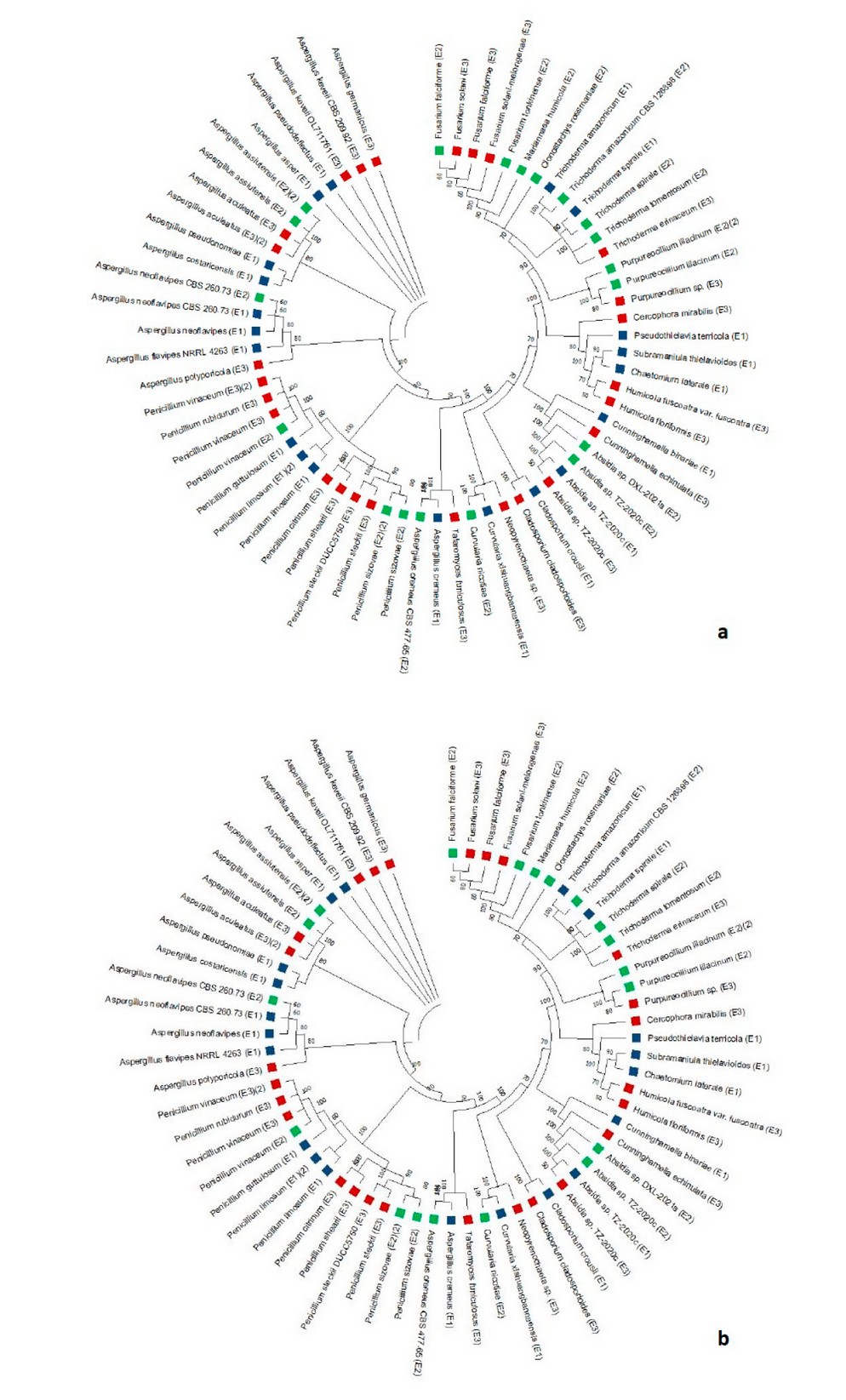
Figura 5. Árbol filogenético de forma circular de las muestras de hongos del Bosque Protector para las regiones ITS (a) y LSU (b).
Conservación de microorganismos
Finalmente 38 cepas fueron conservadas en la Colección de Cultivos Microbianos del CIBE bajo los métodos de aceite mineral, crioconservación y agua para fines de investigación. Entre los microorganismos conservados con su respectivo código de depósito tenemos: Talaromyces liani ( CCMCIBE-H721), Trichoderma inhamatum (CCMCIBE-H722), Penicillium javanicum (CCMCIBE-H723), Curvularia lunata (CCMCIBE-H724), Absidia sp. (CCMCIBE-H725), Trichoderma inhamatum (CCMCIBE-H727), Trichoderma erinaceum (CCMCIBE-H728), Trichoderma saturnisporum (CCMCIBE-H730), Penicillium javanicum (CCMCIBE-H731), Trichoderma amazonicum (CCMCIBE-H733), Trichoderma amazonicum (CCMCIBE-H734), Fusarium solani (CCMCIBE-H735), Trichoderma spirale (CCMCIBE-H736), Cladosporium cladosporioides (CCMCIBE-H738), Fusarium solani (CCMCIBE-H739), Purpureocillium lilacinum (CCMCIBE-H740), Fusarium keratoplasticum (CCMCIBE-H741), Cladosporium ramotenellum (CCMCIBE-H742), Penicillium vinaceum (CCMCIBE-H743), Humicola fuscoatra (CCMCIBE-H744), Curvularia trifolii (CCMCIBE-H745), Gongronella butleri (CCMCIBE-H746), Talaromyces liani (CCMCIBE-H747), Purpureocillium sp. (CCMCIBE-H748), Talaromyces funiculosus (CCMCIBE-H750), Mariannaea aquaticola (CCMCIBE-H753), Aspergillus keveii (CCMCIBE-H754), Bionectria rossmaniae (CCMCIBE-H756), Aspergillus keveii (CCMCIBE-H757), Aspergillus germanicus (CCMCIBE-H758), Talaromyces flavus (CCMCIBE-H759), Penicillium javanicum (CCMCIBE-H760), Penicillium javanicum (CCMCIBE-H762), Aspergillus flavipes (CCMCIBE-H763), Penicillium vinaceum (CCMCIBE-H764), Aspergillus flavipes (CCMCIBE-H765), Aspergillus keveii (CCMCIBE-H767), Penicillium menonorum (CCMCIBE-H768)
En la actualidad, la conservación de microorganismos está tomando más auge debido a su importancia para el estudio de nuevas especies de hongos y su futura aplicación en el área de la agricultura, farmacología o alimentos.23,38–40 Muchas de las especies de hongos pueden verse afectadas por condiciones climáticas como la sequía, temperaturas altas o erosión 41 por lo que programas de conservación son necesarios para mantener a través del tiempo biodiversidad que beneficia al ecosistema en general.
La importancia de la implementación de programas de conservación de la biodiversidad en Ecuador corresponden a la preservación del patrimonio natural del país y sus planes de acción ayudan a reducir las presiones antrópicas sobre estos ambientes debido a los constantes desafíos que surgen producto de la expansión urbana. La concientización de preservar las áreas protegidas a través de la investigación científica debe estar incluida en las políticas de los organismos gubernamentales del ambiente puesto que Ecuador forma parte del Convenio de Diversidad Biológica (CBD) y los resultados de estas investigaciones permiten un enfoque ecosistémico en los mecanismos de conservación. 42,43
CONCLUSIONES
El presente trabajo de investigación ha permitido determinar la diversidad microbiana fúngica en tres diferentes zonas del bosque Protector Prosperina. Como resultado se han obtenido 36 especies únicas de hongos filamentosos a través del análisis molecular de las regiones LSU e ITS del ADN, identificando que existe un gran diversidad microbiológica en el BPP que posee un gran potencial biotecnológico. Se encontró que los géneros más abundantes en el BPP fueron Aspergillus, Penicillium y Trichoderma, especificamente en la estación Cuevas se identificaron aquellos géneros acompañados de Cladosporium, Talaromyces, Absidia, Curvularia, Humicola y Gongronella. En la estación Cañas se registraron especies de Talaromyces, Absidia, Fusarium, Curvularia, Purpureocillium, Clonostachys y Mariannea y en la estación FCV también se presentaron los géneros Cladosporium, Absidia, Purpureocillium, Cinninghamella y Cladosporium. La estudios de la biodiversidad del BPP contribuyen al conocimiento de nuestra riqueza microbiana y constituye una base para nuevas investigaciones en la exploración de hongos filamentosos en los bosques secos tropicales de la costa ecuatoriana. Por otro lado, los resultados permitieron la crioconservación de un total de 38 cepas de hongos filamentosos en la Colección de Cultivos Microbianos del CIBE lo que permitirá investigaciones futuras para la búsqueda de enzimas o metabolitos secundarios de interés en la biotecnología y el desarrollo sostenible.
Financiamiento: La investigación fue financiada por VLIR-UOS, grant Vlir Network Ecuador.
Agradecimiento: Este proyecto fue ejecutado bajo el contrato marco de acceso a recursos genéticos MAAE-DBI-CM-2022-0220, los autores agradecen al Bosque Protector “La Prosperina”, Vlir Network Ecuador, CIBE-ESPOL, FCV-ESPOL y Colección de Cultivos Microbiano CCM-CIBE.
Conflictos of Interés: Los autores declaran no haber conflicto de intereses.
REFERENCES
1. Delgado-Plaza E, Intriago G, Peralta-Jaramillo J, et al. Autonomous installations for monitoring the ‘Protector Prosperina’ forest. Applied Sciences (Switzerland); 9. Epub ahead of print October 1 2019. DOI: 10.3390/app9194034.
2. López Remberto, Carrillo Fernando, Pérez C, et al. REVISIÓN DE LA SUSTENTABILIDAD ECOLÓGICA DE LAS ÁREAS VERDES PROTEGIDAS EN LA CIUDAD DE GUAYAQUIL-PROVINCIA DEL GUAYAS-ECUADOR. In: I Congreso Virtual internacional sobre economía social y desarrollo local sostenible . 2018, pp. 1–16.
3. Sierra Rodrigo. Propuesta preliminar de un sistema de clasificación de vegetación para el Ecuador continental. Proyecto INEFAN/GEF-BIRF y EcoCiencia. Quito, 1999.
4. Quinteros Trelles Aleyda, Ramos Plúas Rebeca Betsabé, Rodríguez Almeida Alex. ‘EVALUACIÓN DEL USO RECREATIVO BOSQUE PROTECTOR PROSPERINA’. Escuela Superior Politécnica del Litoral, 2010.
5. Wang Y, Liu Y, Li J, et al. Fungal community composition and diversity in the rhizosphere soils of Argentina (syn. Potentilla) anserina, on the Qinghai Plateau. Fungal Ecol; 54. Epub ahead of print December 1 2021. DOI: 10.1016/j.funeco.2021.101107.
6. Gabira MM, da Silva RBG, Bortolheiro FP de AP, et al. Composted sewage sludge as an alternative substrate for forest seedlings production. IForest 2021; 14: 569–575.
7. Llonch L, Gordo C, López M, et al. Agronomic characteristics of the compost-bedded pack made with forest biomass or sawdust. Processes; 9. Epub ahead of print 2021. DOI: 10.3390/pr9030546.
8. Meyer V, Basenko EY, Benz JP, et al. Growing a circular economy with fungal biotechnology: A white paper. Fungal Biology and Biotechnology; 7. Epub ahead of print April 2 2020. DOI: 10.1186/s40694-020-00095-z.
9. Zhou Y, Jia X, Han L, et al. Spatial characteristics of the dominant fungi and their driving factors in forest soils in the Qinling Mountains, China. Catena (Amst); 206. Epub ahead of print November 1 2021. DOI: 10.1016/j.catena.2021.105504.
10. Pacasa-Quisbert Fernando, Loza-Murguia Manuel, Bonifacio-Flores Alejandro, et al. Comunidad de hongos filamentosos en suelos del Agroecosistema de K’iphak’iphani, Comunidad Choquenaira-Viacha. Journal of the Selva Andina Research Society 2017; 8: 2–25.
11. Contreras H, Carreño C. Eficiencia de la biodegradación de hidrocarburos de petróleo por hongos filamentosos aislados de suelo contaminado. Revista de Investigación científica UNTRM: Ciencias Naturales e ingeniería, 2018, pp. 27–33.
12. Delgado Madeleyne. Niveles de Coliformes totales y Escherichia coli en Anadara tuberculosa y Anadara similisen el Recinto El Morro, Provincia Del Guayas. Universidad de Guayaquil, 2017.
13. Ochoa B. SISTEMATIZACIÓN DEL CEPARIO DE HONGOS FILAMENTOSOS DE LA UNIVERSIDAD POLITÉCNICA SALESIANA SEDE CUENCA. Universidad Politécnica Salesiana, 2017.
14. Castillo Celi T, Olaya Villavicencio Angel. Estudio de la diversidad de hongos micorrícicos arbusculares provenientes de dos sistemas agroforestales en plantaciones de cacao, un primer paso hacia la obtención de biofertilizante. 2020.
15. Mendoza RB, Espinoza A. Guía técnica para muestreo de Suelos. 2017.
16. Maridueña-Zavala MG, Villavicencio-Vásquez ME, Cevallos-Cevallos JM, et al. Molecular and morphological characterization of Moniliophthora roreri isolates from cacao in Ecuador. Canadian Journal of Plant Pathology; 38. Epub ahead of print 2016. DOI: 10.1080/07060661.2016.1261372.
17. van Burik J-AH, Schreckhise † R W, White TC, et al. Comparison of six extraction techniques for isolation of DNA from filamentous fungi. 1998.
18. Martin KJ, Rygiewicz PT. Fungal-specific PCR primers developed for analysis of the ITS region of environmental DNA extracts. BMC Microbiol; 5. Epub ahead of print May 18 2005. DOI: 10.1186/1471-2180-5-28.
19. Stielow JB, Lévesque CA, Seifert KA, et al. One fungus, which genes? Development and assessment of universal primers for potential secondary fungal DNA barcodes. Persoonia: Molecular Phylogeny and Evolution of Fungi 2015; 35: 242–263.
20. Kearse M, Moir R, Wilson A, et al. Geneious Basic: An integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics 2012; 28: 1647–1649.
21. Kõljalg U, Nilsson RH, Abarenkov K, et al. Towards a unified paradigm for sequence-based identification of fungi. Molecular Ecology 2013; 22: 5271–5277.
22. Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol 2011; 28: 2731–9.
23. Maridueña-zavala MG, Quevedo A, Aguaguiña K, et al. Colección de cultivos microbianos CIBE ( CCM-CIBE ): Una colección para la investigación Microbial Culture Collection from CIBE ( CCM-CIBE ): A collection for research. Epub ahead of print 2021. DOI: 10.21931/RB/2021.06.01.32.
24. Buée M, Reich M, Murat C, et al. 454 Pyrosequencing analyses of forest soils reveal an unexpectedly high fungal diversity. New Phytologist 2009; 184: 449–456.
25. Totubaeva NE, Shalpykov KT. Dynamics of Microbiological Diversity of Soils in the Chu Valley during Land Use Change in Pastures. Arid Ecosystems 2022; 12: 187–192.
26. Tang GT, Li Y, Zhou Y, et al. Diversity of Trichoderma species associated with soil in the Zoige alpine wetland of Southwest China. Sci Rep; 12. Epub ahead of print December 1 2022. DOI: 10.1038/s41598-022-25223-0.
27. Mulatu A, Megersa N, Abena T, et al. Biodiversity of the Genus Trichoderma in the Rhizosphere of Coffee (Coffea arabica) Plants in Ethiopia and Their Potential Use in Biocontrol of Coffee Wilt Disease. Crops 2022; 2: 120–141.
28. Gams W. Biodiversity of soil-inhabiting fungi. Biodiversity and Conservation 2007; 16: 69–72.
29. Woo SL, Hermosa R, Lorito M, et al. Trichoderma: a multipurpose, plant-beneficial microorganism for eco-sustainable agriculture. Nat Rev Microbiol. Epub ahead of print 2022. DOI: 10.1038/s41579-022-00819-5.
30. Altaf MM, Imran M, Abulreesh HH, et al. Diversity and applications of penicillium spp. in plant-growth promotion. In: New and Future Developments in Microbial Biotechnology and Bioengineering: Penicillium System Properties and Applications. Elsevier, 2017, pp. 261–276.
31. Godinho VM, Gonçalves VN, Santiago IF, et al. Diversity and bioprospection of fungal community present in oligotrophic soil of continental Antarctica. Extremophiles 2015; 19: 585–596.
32. GINTING RCB, SUKARNO N, WIDYASTUTI UTUT, et al. Diversity of Endophytic Fungi from Red Ginger (Zingiber officinale Rosc.) Plant and Their Inhibitory Effect to Fusarium oxysporum Plant Pathogenic Fungi. Hayati 2013; 20: 127–137.
33. Thailand, Seephueak P, Preecha C, et al. The diversity of fungi associated with rice (Oryza sativa L. International Journal of Agricultural Technology 2019; 15: 485–500.
34. Vera-Morales M, López Medina SE, Naranjo-Morán J, et al. Nematophagous Fungi: A Review of Their Phosphorus Solubilization Potential. Microorganisms 2023; 11: 137.
35. Iturrieta-González I, García D, Gené J. Novel species of Cladosporium from environmental sources in Spain. MycoKeys 2021; 77: 1–25.
36. Liang G, Zhang M, Xu W, et al. Characterization of mitogenomes from four Mucorales species and insights into pathogenicity. Mycoses 2022; 65: 45–56.
37. Flores Bazauri Walter, Chico Ruiz Julio, Cerna Rebaza Lisi. Vista de Actividad antagónica in vitro de Clonostachys rosea sobre Fusarium oxysporum, Alternaria solani y Botrytis cinerea. Revista científica de la Facultad de ciencias Biológicas, 2015, pp. 34–42.
38. Sharma SK, Saini S, Verma A, et al. National Agriculturally Important Microbial Culture Collection in the Global Context of Microbial Culture Collection Centres. Proceedings of the National Academy of Sciences India Section B – Biological Sciences 2019; 89: 405–418.
39. Desmeth P, Officer IC. World Federation for Culture Collections Guidelines for the Establishment and Operation of Collections of Cultures of. 2010; 1–19.
40. Sharma A, Shouche Y. Microbial Culture Collection (MCC) and International Depositary Authority (IDA) at National Centre for Cell Science, Pune. Indian J Microbiol 2014; 54: 129–133.
41. Tedersoo L, Mikryukov V, Zizka A, et al. Global patterns in endemicity and vulnerability of soil fungi. Glob Chang Biol. Epub ahead of print 2022. DOI: 10.1111/gcb.16398.
42. Zárate K. Manual para la Gestión Operativa de las Áreas Protegidas de Ecuador. 2013.
43. Delgado-Plaza E, Intriago G, Peralta-Jaramillo J, et al. Autonomous installations for monitoring the ‘Protector Prosperina’ forest. Applied Sciences (Switzerland); 9. Epub ahead of print October 1 2019. DOI: 10.3390/app9194034.
Received: September 26, 2022 / Accepted: October 15, 2022 / Published:15 February 2023
Citation: Carreño, G.; Quijije, G.; Diaz, B.; Maridueña, M; Cevallos, J. Identificación de hongos filamentosos asociados al suelo del bosque protegido de Prosperina. Revis Bionatura 2023;8 (1)22. http://dx.doi.org/10.21931/RB/2023.08.01.22



















