Vol 8 No 1 2023 – 11

Condiciones óptimas de extracción de compuestos antioxidante del alga roja Acanthophora spicifera
Optimal conditions for the extraction of antioxidant compounds from the red alga Acanthophora spicifera.
Arianna Valdez N1*, Iván Choez2, Sofie Van Der Hende3, Omar Ruìz4, Patricia Manzano5
1 ESPOL Polytechnic University, Facultad de Ciencias de la Vida (FCV), Campus Gustavo Galindo, Km. 30.5 vía Perimetral, P.O. Box 09-01-5863, Guayaquil, Ecuador
2 ESPOL Polytechnic University, Centro de Investigaciones Biotecnológicas del Ecuador (CIBE), Campus Gustavo Galindo Km 30.5 vía Perimetral, P.O. Box 09-01-5863, Guayaquil, Ecuador
3 ESPOL Polytechnic University, Centro Nacional de Acuicultura e Investigaciones Marinas (CENAIM), Campus Gustavo Galindo Km 30.5 vía Perimetral, P.O. Box 09-01-5863, Guayaquil, Ecuador
4 ESPOL Polytechnic University, Facultad de Ciencias Naturales y Matemáticas (FCNM), Campus Gustavo Galindo, Km. 30.5 vía Perimetral, P.O. Box 09-01-5863, Guayaquil, Ecuador
5 ESPOL Polytechnic University, Centro de Investigaciones Biotecnológicas del Ecuador (CIBE), Campus Gustavo Galindo Km 30.5 vía Perimetral, P.O. Box 09-01-5863, Guayaquil, Ecuador
e-mails: alvaldez@espol.edu.ec 1*, iachoez@espol.edu.ec2 shende@espol.edu.ec3 oruiz@espol.ecu.ec4,
pmanzano@espol.edu.ec5
http://dx.doi.org/10.21931/RB/2023.08.01.11
RESUMEN
La Acanthophora spicifera un alga roja de fácil adaptación a diferentes condiciones ambientales, por su capacidad de regenerarse por fragmentación, convirtiéndola en una especie invasora en áreas tropicales y subtropicales. Además, es conocida por sus componentes bioactivos (antioxidantes, fitohormonas, fitopigmentos). En este estudio se plantea determinar las condiciones óptimas de extracción de compuestos antioxidantes de la macroalga que crece en la zona intermareal de la playa de San Pedro de la provincia de Santa Elena, en dos procesos de secado (horno y liofilización) y extracción etanólica (digestión y ultrasonido) a diferentes concentraciones de etanol (50% y 70%) en rangos de tiempo y temperatura para su posterior determinación de actividad antioxidante por los métodos DPPH, ABTS, fenoles, flavonoides y auxinas totales en microplacas. Los datos se analizaron mediante análisis de varianza (ANOVA) usando el software estadístico R.4.2.0 e InfoStat, observan que los mejores resultados se dieron por digestión con una concentración de etanol al 50% y se obtuvieron valores para: la actividad captadora de radicales DPPH 3.65±0.011 µmol ET/g ps, mayor actividad inhibidora del radical catiónico ABTS 14.06±0.03 µmol ET/g ps, para flavonoides 1278.58±2.94 µg EQ/g ps, para fenoles 900±0.129 µg GEA/g ps. Las condiciones óptimas para la extracción etanolica de la macroalga A. spicifera., fueron 47 °C y 47 minutos para la actividad captadora de radicales DPPH y 47 °C y 39 minutos para la actividad inhibidora del radical catiónico ABTS, 45 °C y 37 minutos para Fenoles totales y 43 °C y 38 minutos para Flavonoides totales.
Palabras clave: actividad antioxidante, Acanthophora spicifera, optimización
ABSTRACT
Acanthophora spicifera is a red seaweed that is easily adapted to different environmental conditions due to its ability to regenerate by fragmentation, making it an invasive species in tropical and subtropical areas. In addition, it is known for its bioactive components (antioxidants, phytohormones, and phytopigments). This study proposes to determine the optimal conditions for extracting antioxidant compounds from the macroalgae that grow in the intertidal zone of San Pedro beach in the province of Santa Elena, in two drying processes (oven and freeze-drying) and ethanolic extraction (digestion and ultrasound) at different ethanol concentrations (50% and 70%) in time and temperature ranges for subsequent determination of antioxidant activity by the DPPH, ABTS, phenols, flavonoids, and total auxin methods in microplates. . The data were analyzed by analysis of variance (ANOVA) using the statistical software R.4.2.0 and InfoStat, they observe that the best results were given by digestion with a 50% ethanol concentration and values were obtained for: activity radical scavenger DPPH 3.65±0.011 µmol ET/g d.w., higher cationic radical inhibitory activity ABTS 14.06±0.03 µmol ET/g d.w., for flavonoids 1278.58±2.94 µg EQ/g d.w., for phenols 900±0.129 µg GEA/g d.w. The optimal conditions for the ethanolic extraction of the macroalga A. spicifera were 47 °C and 47 minutes for the DPPH radical scavenging activity and 47 °C and 39 minutes for the ABTS cationic radical inhibitor activity, 45 °C and 37 minutes for total phenols and 43 °C and 38 minutes for total flavonoids.
Keywords: antioxidant activity, Acanthophora spicifera, optimization
INTRODUCCIÓN
La Acanthophora spicifera es un alga roja ampliamente distribuida en mares subtropicales y tropicales y se encuentra en muchos hábitats intermareales y submareales. Está distribuida desde los arrecifes poco profundos hasta profundidades de hasta 17m reportado en Puerto Rico y 22m en las Islas Vírgenes 1, esta macroalga se la considera como una especie invasora en las islas del Pacífico central y en lugares como Hawaii es la principal invasora2, esto se debe a su estrategia reproductiva sexual como asexual, la capacidad de regenerarse por fragmentación y que se adapta fácilmente a diversas condiciones ambientales por lo que representa una amenaza para su nuevo ecosistema.3,4A lo largo de diversos estudios se ha encontrados que posee diversas propiedades en como bioindicador de enriquecimiento de nutrientes, también se ha documentado que es un buen productor de oxígenos y como materia prima para la producción de biocombustible por su alto contenido en lignina2.
Los principales antioxidantes encontrados en las algas marinas son compuestos fenólicos y pigmentos fotosintéticos (clorofilas, carotenoides y ficobiliproteínas), que también son conocidos por sus actividades biológicas (anticancerígenas, antiinflamatorias, antiobesidad y antiangiogénicas)5. Sin embargo, tanto los compuestos fenólicos como los pigmentos son susceptibles a la oxidación, especialmente a altas temperaturas6. Además, las algas marinas se consideran una fuente alternativa de proteínas, carbohidratos, ácidos grasos y minerales, que pueden sufrir degradación a temperaturas elevadas y pérdida de agua, el uso de algas marinas como ingrediente en la industria alimentaria a menudo requiere que se deshidrate antes de su uso7, ya que el secado inhibe la actividad microbiológica y ralentiza o detiene las reacciones químicas que causan el deterioro de los alimentos (es decir, oxidación o reducción), prolongando así la vida útil 7,8 y ayuda a la extracción de ciertos componentes químicos9.
Los procesos de secado más comunes utilizados para las algas marinas son: el secado al sol, el secado al horno y la liofilización10, el procesamiento de cada método puede cambiar la composición química y las propiedades antioxidantes de las algas destinadas a ser utilizadas como bioproductos funcionales para alimentos y piensos (alimento para el ganado), aplicaciones cosméticas, farmacéuticas e industriales11,12. Si bien existen diferentes técnicas de secado disponibles, varios factores como el costo, el consumo de energía, la efectividad y el impacto en la calidad de los alimentos deben tenerse en cuenta al seleccionar el método más apropiado13,14.
Sin embargo, cuando se seca al sol, las algas marinas se exponen al aire libre a la luz solar directa, donde hay una gran oportunidad de contaminación en el aire (es decir, con partículas, microbios, etc.) que luego pueden afectar la calidad e higiene del producto final15.Diferentes estudios han demostrado el valor de selección de tratamientos de secado apropiados para preservar compuestos bioactivos importantes de las algas destinadas a diferentes procesos16, aunque existen pocos estudios que describan los efectos de los procesos de secado en los extractos de algas marinas17, el interés en este tema ha aumentado en los últimos años 18,19.
El objetivo de este estudio fue determinar las condiciones óptimas de extracción de compuestos antioxidantes del alga roja A. spicifera empleando diferentes métodos de secado para preservar la calidad de los biocomponentes del producto final, Las muestras secas se extrajeron mediante dos métodos diferentes (digestión y extracción asistida por ultrasonido) utilizando etanol a diferentes concentraciones.
MATERIALES Y MÉTODOS
Los productos químios que se utilizaron eran de grado analítico y se obtuvieron de Sigma-Aldrich
Material de alga y metodos de secado
La macroalga A. spicifera, se cosecho en la playa de San Pecdro de Manglralto de la provincia de Santa Elena en el mes de enero del 2021. Las algas cosechadas se lavaron con agua potable para eliminar las epifitas y luego se las dividieron en grupos para probar el efecto de diferentes métodos de secado sobre la actividad antioxidante, los compuestos fenolicos y polifenoles.
Las algas se secaron de la suiguiente manera: se secaron al horno de estufa ventilada por 36 h a 45°C y secado por liofilización por durante 60 h, despues todas las muestras se molieron durante 1 minuto en un molino de alta velocidad.
Extracciones
Las muestras de algas se extrajeron con etanol al 50% y etanol al 70% utilizando dos métodos de extracción, colocando la muestra de alga seca y el solvente en una relación 1:15, se aplico los siguientes metodos de extracción: digestión a 40, 45 y 50 °C durante 30, 40 y 50 minutos; y extracción asistida por ultrasonido (UEA) a 40kHz de frecuencia a temperatura ambiente durante 10,20 y 30 minutos. Despues de las extracciones, la muestras se centrifugaron a 12000 rpm durante 10 min a 4 °C. Todos los extractos se mantuvieron en congelación a -4°C antes de los análisis. Cada extracción se lo realizó por duplicado.
Actividad antiódiante
La actividad antioxidante de los extractos de A. spicifera se evaluo mediante dos métodos diferentes: DPPH (1,1-difenil-2-picrilhidrazilo) y ABTS (Ácido 2, 2’-azinobis(3-etilbenzotiazolín)-6-sulfónico).
Se midió la capacidad de captación de radicales libres DPPH de los extractos descrita por Viteri et al.,202120 en una placa de 96 posillos, después de 30 minutos de incubación en oscuridad se midió la absorbancia a 517 ηm usando un Lector multi-modal Synergy HTX con detector UV-VIS (Biotek).
Se midio la actividad inhibidora del radical catiónico ABTS de los extractos descrita por Viteri et al.,202120 en una placa de 96 posillos, se incubo durante 30 min y se midió la absorbancia en una longitud de onda de 732 ηm. Los resultados de la actividad antioxidante fueron expresados como µmol equivalentes de Trolox por gramo de peso seco (µmol TE). Se utilizaron concentraciones de Trolox entre (10 – 200 µmol/L) para DPPH y ABTS.
Composición fenólica
Los extractos obtenidos se analizaron para contenido fenólico total (TPC) y contenido total de flavonoides (TFC)
Para el TPC de los extractos de A. spicifera se realizó el método colorimétrico Folin-Ciocalteu empleado por Zhong et al.,202021. Se agregó 25 µL de muestra, 25 µL de solución folin al 25% (v/v) y 200 µL de agua destilada en los pocillos de una placa de 96 pocillos y se incubaron durante 5 min a 25°C. Posteriormente se agregó 25 µL de carbonato de sodio al 10% (p/p) y dejando incubar durante 1 hora a 25°C. La absorbancia se midió a 765 ɳm en un espectrofotómetro UV-160A (Shimadzu). En la curva de calibración estándar (10 – 250 µmol/L) se utilizó ácido gálico (y = 0,0041x + 0,029,R² = 0,9952) y los resultados se presentaron en mg equivalentes de ácido gálico (GAE) por gramo de extracto seco (mg GAE/g).
Los TFC de los extractos de A. spicifera se realizó el método colorimétrico del cloruro de aluminio como lo describe Avramova et al.,201722. En una placa de 96 pocillos se reaccionó 20 µL de muestra y 200 µL de una mezcla de reactivos en donde se utilizó 60 µL de etanol, 10 µL de cloruro de aluminio al 10% (w/v), 10 µL de acetato de potasio al 1M y 120 µL de agua destilada, dejando incubar a temperatura ambiente durante 30 min para su posterior lectura a una absorbancia de 415 ɳm usando un Lector multi-modal Synergy HTX con detector UV-VIS (Biotek). La medición se comparó con una curva de calibración (10 – 100 µmol/L) preparada con soluciones de catequina (y = 0,006x – 0,0249, R² = 0,9979) y el resultado se expresó en µg equivalentes de catequina (CE) por gramo de extracto seco23.
Análisis estadistico
Las diferencias significativas entre los tratamientos fueron determinados estadísticamente utilizado, un análisis de desviación estándar y un análisis de matriz de dispersión para tipo de secado (X1), concentración de Etanol (X2), tipo de extracción (X3), con estas nuevas condiciones se realizó el análisis de superficie de respuesta analizando el efecto de las variables de temperatura (X4) y tiempo (X5) de extracción sobre las variables de la actividad captadora de radicales DPPH (Y1), la actividad inhibidora del radical catiónico ABTS (Y2), de los y el contenido de fenoles totales (Y3), el contenido de flavonoides totales (Y4) respectivamente para todo el proceso estadístico se emplearon los softwares estadísticos Rstudio e InfoStat obteniendo el los modelos matemáticos, gráficas y la verificación de los valores óptimos.
RESULTADOS
Actividad Antioxidante
La actividad antioxidante se determinó utilizando los ensayos DPPH y ABTS y los resultados se muestra en las figuras 1 y 2 Los valores de DPPH en los extractos de A. spicifera oscilaron entre 0,171±0,06 y 3,651±0,61 µmol TE. Las muestras secadas al horno con etanol al 50% tubieron valores mas altos para todos los métodos de extracción. Al utilizar etanol al 70% en muestras liofilizadas se tubieron un DPPH mas bajo que en las muestras secadas al horno. El secado al horno muestra ser un mejor metodo de secado para obtener extractos con alta actividad captadora de radicales libres.
Al comparar los metodos de extracción una mayor actividad captadora de radicales libres se obtuvo en el método de digestión teniendo valores altos entre 3,240±0.01 y 3,651±0,61 µmol TE, en cuanto al metodo UEA se obtuvo dos valores altos; 3,151±0.12 y 3,478±0,01 µmol TE con un tiempo de 20 y 30 min respectivamente.
Los extractos de A. spicifera mostraron una actividad inhibidora de radical cationico, ABTS, entre 4,645±0,08 y 14,033±0,04 µmol TE. Al igual que en el ensayo de DPPH las muestras secadas al horno tratadas con etanol al 50% se evidenció valores altos en todos los métodos de extración, los valores mas altos se obtuvieron con el metodo de digestión a 45°C y 30 min. Con el método UEA tambien se obtivieron valores altos en la muestra liofilizada durante 10 min (11,445±0,05 µmol TE) y secada al horno durante 30 min (13,845±0,11 µmol TE).
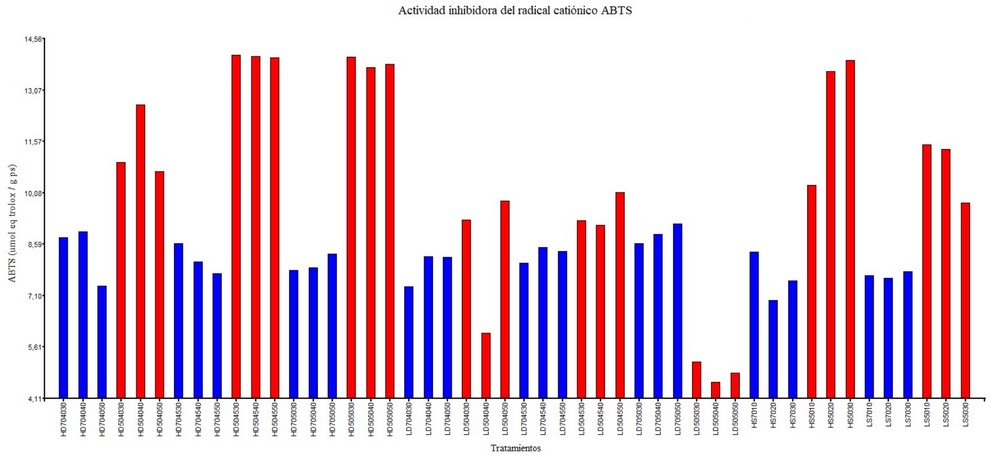
Figura 1. Actividad captadora de radicales libres – DPPH de los extractos de A. spicifera: tipo de secado: secado al horno (H), lifilizado (L); extracción: digestión (D), extracción asistida por ultrasonido (S); solvente: etanol 70% (70-azul), etanol 50% (50-rojo); temperatura: 40, 45 y 50; tiempo: 10, 20, 30, 40, 50.
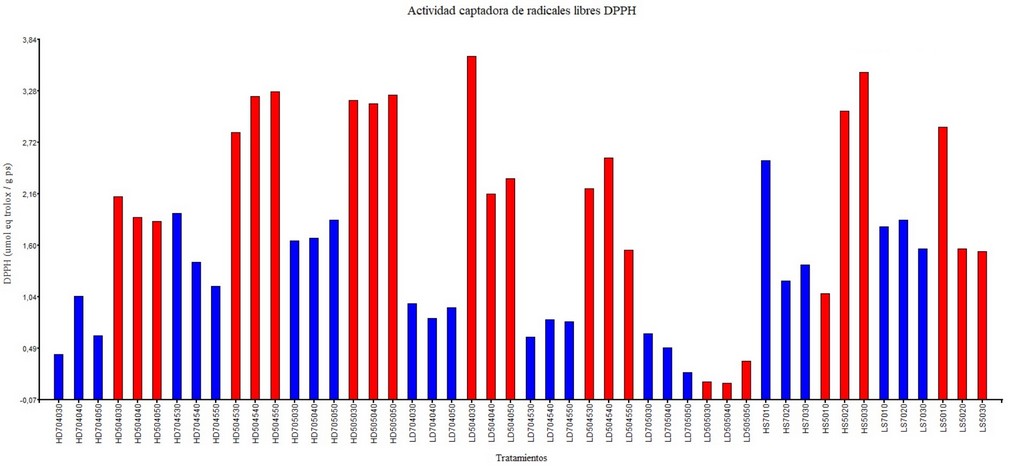
Figura 2. Actividad inhibidora del radical cationico – ABTS de los extractos de A. spicifera: tipo de secado: secado al horno (H), lifilizado (L); extracción: digestión (D), extracción asistida por ultrasonido (S); solvente: etanol 70% (70-azul), etanol 50% (50-rojo); temperatura: 40, 45 y 50; tiempo: 10, 20, 30, 40, 50.
Composición fenólica
Los resultados de TPC y TFC para estractos de A. spicifera se muestran en la tabla 2. El TPC de A. specifera osciló entre 0,109±0.01 y 0,941±0.01 mg GAE /g p.s., los extractos liofilizados tuvieron un TPC mas altos en comparación con secado al horno, en algunos casos las muestra liofilizadas eran dos veces mas TPC que las muestras secadas al horno. Los resultados mostrano que el metodo de secado por liofilización fue el mejor metodo para conservar TPC en materia de algas.
Comparando los solventes en extracción en muestras liofilizadas, las que se extrajeron con etanol al 50% se obtuvo TPC mas altos que las extraidas con etanol al 70%. El TPC mas alto se encontró en la muestra extraida por digestión con temperatura de 40°C y 40 minutos en etanol al 50% (0,941±0,01 mg GAE /g p.s). Las muestras liofilizadas extraidas con etanol al 70% tubieron los resultados mas bajos para todos los métodos de extracción. El TPC mas alto entre las muestras secadas al horno fueron los extractos preparados con etanol al 50% utilizando EAU durante 30 minutos (0,834±0,05 mg GAE /g p.s).
El TFC de A. specifera osciló entre 73,778±5,67 y 1281,083±3,53 ug QE/g p.s., los extractos liofilizados tuvieron un TFC mas altos en comparación con secado al horno, en algunos casos las muestra liofilizadas era entre tres y seis veces mas que las muestras secadas al horno. Los resultados obtenidos en el secado por liofilización fue el mejor metodo para conservar TFC en materia de algas.
Se pudo observar una diferencia significativa en la extracción en muestras liofilizadas, las que se extrajeron con etanol al 50% se obtuvo TFC mas altos que las extraidas con etanol al 70%. El valor mas alto de TFC se obtivo en la muestra extraida por digestión con temperatura de 50°C y 30 minutos en etanol al 50% (1281,083±3,53 ug QE /g p.s). Las muestras liofilizadas extraidas con etanol al 70% tubieron los resultados mas bajos para todos los métodos de extracción. El TFC mas alto entre las muestras secadas al horno fue el extracto preparados con etanol al 70% utilizando digestión a una temperatura de 40°C y 40 minutos (504,577±5,75 mg GAE /g p.s).
Encuanto al metodo EAU los valores mas altos fueron con secado por liofilización durante 30 minutos con etanol al 70% (307,994±1,57 ug QE /g p.s.), mientras que el mas bajo se obtuvo con etanol al 70% durante 20 minutos.
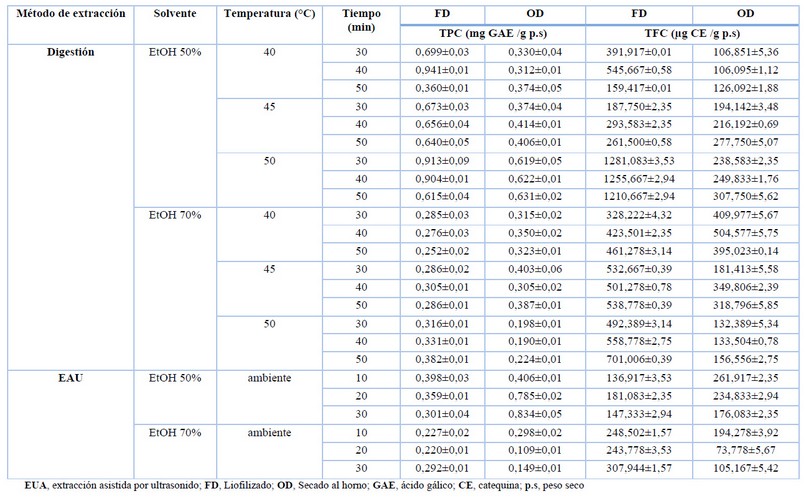
Tabla 1. Contenido de fenoles totales (TPC) y contenido de flavonoides totales (TFC) de los extractos de A. spicifera.
Optimización
El análisis de superficie de respuesta se ha obtenido de los datos experimentales donde el análisis con la matriz de dispersión indica que el tiempo y temperatura de extracción tuvieron un efecto cuadrático sobre la actividad captadora de radicales DPPH y su influencia la vemos reflejada en la ecuación (1).
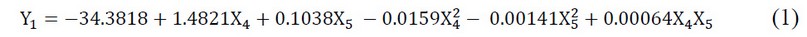
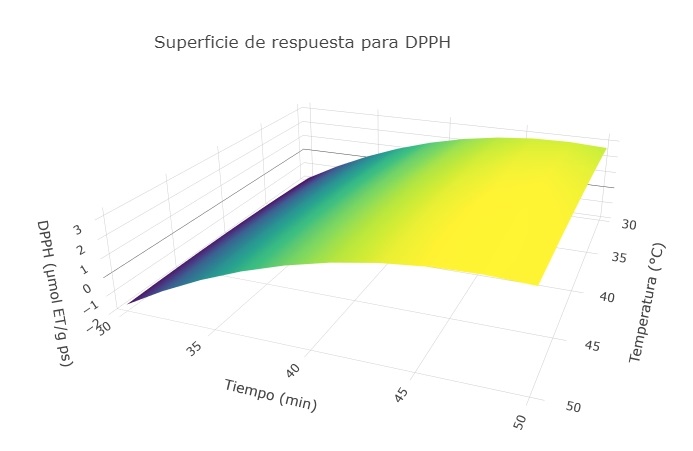
Figura 3. Efecto de la temperatura y el tiempo de extracción sobre la actividad captadora de radicales DPPH
Con los analisis de sobre la actividad inhibidora del radical catiónico ABTS se demostró que los parámetros de extracción ejercieron un efecto cuadrático. El efecto de la temperatura y el tiempo de extracción sobre la actividad inhibidora del radical catiónico ABTS se muestra en la ecuación (2) a continuación:
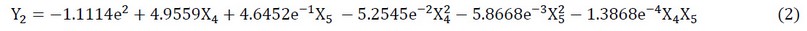
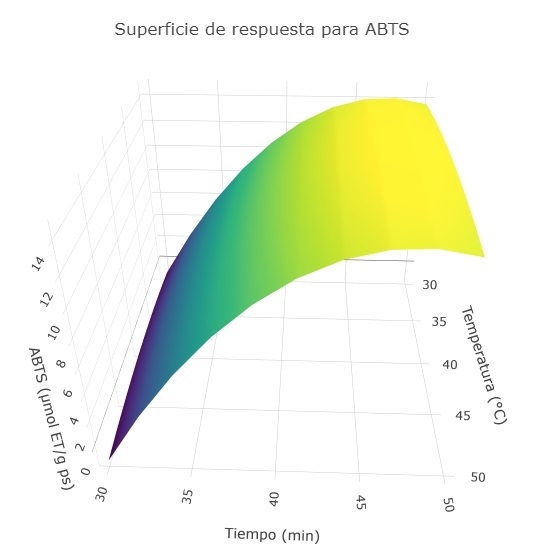
Figura 4. Efecto de la temperatura y el tiempo de extracción sobre la actividad inhibidora del radical catiónico ABTS.
El análisis de superficie de respuesta de los contenido de fenoles totales (TPC) y contenido de flavonoides totales (TFC) de los extractos de A. spicifera obtenido de los datos experimentales que se muestran en la Tabla 1, demostró que los parámetros de extracción ejercieron un efecto cuadrático sobre el contenido de fenoles totales. El efecto de la temperatura y el tiempo de extracción sobre el contenido de fenoles totales se muestra en la ecuación (3) a continuación:


Figura 5. Efecto de la temperatura y el tiempo de extracción sobre el contenido de fenoles
Para el contenido flavonoides totales se demostró que los parámetros de extracción ejercieron un efecto cuadrático, el efecto de la temperatura y el tiempo de extracción sobre el contenido de fenoles totales se muestra en la ecuación (4) a continuación:
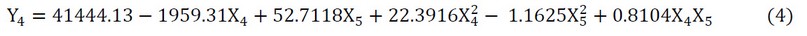

Figura 6. Efecto de la temperatura y el tiempo de extracción sobre el contenido de flavonoides totales
DISCUSIÓN
Los resultados obtenidos al compáralo con otros estudios con diferentes métodos de extracción con la misma alga A. spicifera podemos observar que existe una diferencia entre el alga que crece en Ecuador con la que crece en la India en el caso del % DPPH se obtuvo un 19.29±0.011 en comparación con 6.91±0.42 que tiene un proceso de extracción por maceración por 24 h con metanol al 98% 25. En cuanto a fenoles totales se extrajo 60.24±0.129 µg GAE /mL mientras que en estudio de Murugan et al. 2014 nos indica que obtuvo 0.87±0.10 µg GAE /mL con una extracción con metanol al 98% y 0.24±0,08 µg/mL GAE con una extracción con agua, así mismo se reporta que obtuvieron 25.7±0.6 µg QE /mL en extracción con metanol al 98% mientras que en la extracción con agua reportaron 8,5±0,4 µg QE /mL en la extracción de flavonoides totales24, comparado con la extracción que se realizó con etanol al 50% que fue de 85.41±3.53 µg QE /mL.
CONCLUSIONES
Los resultados de este estudio contribuyen a la caracterización del alga roja A. spicifera como una matriz que puede producir componentes con potencial antioxidantes.
Con el análisis de superficie de respuesta se obtuvo las condiciones temperatura y tiempo óptimo de extracción a 47 °C y 47 minutos para la actividad captadora de radicales libres DPPH, para la actividad inhibidora del radical catiónico ABTS 47 °C y 39 minutos, para fenoles totales 45 °C y 37 minutos y en flavonoides totales 43 °C y 38 minutos en los extractos etanolicos al 50%.
La Acanthophora spicifera que crece en Ecuador se extrajo una mayor cantidad de fenoles y flavonoides (60.24±0.129 µg GAE /mL y 85.41±3.53 µg QE /mL) en comparación con la que crece en India (0.87±0.10 µg GAE /mL y 25.7±0.6 µg QE /mL).
Los resultados obtenidos de este estudio muestran que A. spicifera debería tener una buena actividad antioxidante a pesar de un TPC relativamente bajo, pero se deben realizar más análisis para identificar el perfil fenólico de los extractos, el efecto estacional sobre el contenido fitoquímico, así como su potencial biológico.
Contribuciones de los autores: “Conceptualización, Patricia Manzano, PhD; metodología, Ing. Qco Arianna Valdez, e Ing. Qco Ivan Choez; software, Omar Ruiz, PhD ; validación, Ing. Qco Ivan Choez; investigación, Ing. Qco Arianna Valdez; recursos, Sofie Van Der Hende; curación de datos, Omar Ruiz, PhD; redacción—preparación del borrador original, Ing. Qco Arianna Valdez; “Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiamiento: Esta investigación es apoyada por el proyecto SIRENA financiado por VLIR-UOS,
Declaración de la Junta de Revisión Institucional: No aplicable
Declaración de consentimiento informado: No aplicable
.
Declaración de disponibilidad de datos: Disponibilidad de datos previa solicitud
Agradecimientos: Al Ministerio del Ambiente del Ecudaor por el apoyo otorgado a esta investigación y al proyecto SIRENA
Conflictos de interés: Los autores declaran no tener conflicto de interés
REFERENCIAS
1. Ceramiales R. A taxonomic , of species relationships Acanthophora study phylogenetic general and biogeographical biogeographical phologically distinguishable species , Jong Rhodophyta ), phylogenetic biogeographical analysis , monophyletic algae ( Falkenberg ,. 1999;44:217-249.
2. CONABIO. Método de Evaluación Rápida de Invasividad (MERI) para especies exóticas en México. Published 2017. Accessed October 19, 2022. https://enciclovida.mx/pdfs/exoticas_invasoras/Acanthophora%20spicifera.pdf
3. Schnӧller VCG. Caracterización química del alga roja Acanthophora spicifera (M . Vahl) Børgesen (Ceramiales: Rhodophyta) en La Bahía De La Paz, Baja California Sur, México. Published online 2016:64.
4. Budiyanto F, Ghandourah MA, Bawakid NO, Alorfi HS, Abdel-Lateff A, Alarif WM. Threat and gain: The metabolites of the red algae genus Acanthophora. Algal Res. 2022;65:102751. doi:10.1016/J.ALGAL.2022.102751
5. Pangestuti R, Kim SK. Biological activities and health benefit effects of natural pigments derived from marine algae. J Funct Foods. 2011;3(4):255-266. doi:10.1016/j.jff.2011.07.001
6. Humphrey AM. Chlorophyll as a Color and Functional Ingredient. J Food Sci. 2006;69(5):C422-C425. doi:10.1111/j.1365-2621.2004.tb10710.x
7. Gupta S, Cox S, Abu-Ghannam N. Effect of Different Drying Temperatures on the Moisture and Phytochemical Constituents of Edible Irish Brown Seaweed Recommended Citation Effect of different drying temperatures on the moisture and phytochemical constituents of edible Irish brown seaweed. LWT-Food Science and Technology. Published online 2011. doi:10.1016/j.lwt.2010.12.022
8. Gupta S, Abu-Ghannam N. Recent developments in the application of seaweeds or seaweed extracts as a means for enhancing the safety and quality attributes of foods. Innovative Food Science and Emerging Technologies. 2011;12(4):600-609. doi:10.1016/j.ifset.2011.07.004
9. Ito K, Hori K. Seaweed: Chemical composmon and potential food uses. Food Reviews International. 1989;5(1):101-144. doi:10.1080/87559128909540845
10. Ling ALM, Yasir S, Matanjun P, Abu Bakar MF. Effect of different drying techniques on the phytochemical content and antioxidant activity of Kappaphycus alvarezii. J Appl Phycol. 2015;27(4):1717-1723. doi:10.1007/s10811-014-0467-3
11. Jiménez-Escrig A, Jiménez-Jiménez I, Pulido R, Saura-Calixto F. Antioxidant activity of fresh and processed edible seaweeds. J Sci Food Agric. 2001;81(5):530-534. doi:10.1002/jsfa.842
12. le Lann K, Jégou C, Stiger-Pouvreau V. Effect of different conditioning treatments on total phenolic content and antioxidant activities in two Sargassacean species: Comparison of the frondose Sargassum muticum (Yendo) Fensholt and the cylindrical Bifurcaria bifurcata R. Ross. Phycological Res. 2008;56(4):238-245. doi:10.1111/j.1440-1835.2008.00505.x
13. Chen J, Li M, Yang R, Luo Q, Xu J, Ye Y. Profiling lipidome changes of Pyropia haitanensis in short-term response to high-temperature stress. Published online 2015. doi:10.1007/s10811-015-0733-z
14. Stramarkou M, Papadaki S, Kyriakopoulou K. Effect of drying and extraction conditions on the recovery of bioactive compounds from Chlorella vulgaris. Published online 2017. doi:10.1007/s10811-017-1181-8
15. Wong K, Chikeung Cheung P. Influence of drying treatment on three Sargassum species 2. Protein extractability, in vitro protein digestibility and amino acid profile of protein concentrates. J Appl Phycol. 2001;13(1):51-58. doi:10.1023/A:1008188830177
16. Kadam SU, Álvarez C, Tiwari BK, O’Donnell CP. Processing of seaweeds. In: Seaweed Sustainability: Food and Non-Food Applications. Elsevier Inc.; 2015:61-78. doi:10.1016/B978-0-12-418697-2.00004-0
17. Rioux LE, Beaulieu L, Turgeon SL. Seaweeds: A traditional ingredients for new gastronomic sensation. Food Hydrocoll. 2017;68:255-265. doi:10.1016/j.foodhyd.2017.02.005
18. Chenlo F, Arufe S, Díaz D, Torres MD, Sineiro J, Moreira R. Air-drying and rehydration characteristics of the brown seaweeds, Ascophylum nodosum and Undaria pinnatifida. J Appl Phycol. 2018;30(2):1259-1270. doi:10.1007/s10811-017-1300-6
19. Badmus UO, Taggart MA, Boyd KG. The effect of different drying methods on certain nutritionally important chemical constituents in edible brown seaweeds. J Appl Phycol. 2019;31(6):3883-3897. doi:10.1007/s10811-019-01846-1
20. Viteri R, Giordano A, Montenegro G, Zacconi F. Eucryphia cordifolia extracts: Phytochemical screening, antibacterial and antioxidant activities. https://doi.org/101080/1478641920211960525. 2021;36(16):4177-4181. doi:10.1080/14786419.2021.1960525
21. Zhong B, Robinson NA, Warner RD, Barrow CJ, Dunshea FR, Suleria HAR. LC-ESI-QTOF-MS/MS Characterization of Seaweed Phenolics and Their Antioxidant Potential. Mar Drugs. 2020;18(6). doi:10.3390/MD18060331
22. Avramova V, Abdelgawad H, Vasileva I, et al. High antioxidant activity facilitates maintenance of cell division in leaves of drought tolerant maize hybrids. Front Plant Sci. 2017;8(FEBRUARY):84. doi:10.3389/FPLS.2017.00084/BIBTEX
23. Chang CC, Yang MH, Wen HM, Chern JC. Estimation of Total Flavonoid Content in Propolis by Two Complementary Colorimetric Methods. J Food Drug Anal. 2002;10(3):178-182. Accessed September 17, 2022. https://scholar.google.com/scholar_lookup?author=C.+C.+Chang&author=M.+H.+Yang&author=H.+M.+Wen&author=J.+C.+Chern+&publication_year=2002&title=Estimation+of+total+flavonoid+content+in+propolis+by+two+complementary+colorimetric+methods&journal=J.+Food+Drug+Anal.&volume=10&pages=178-182
24. Murugan K, Iyer VV. Antioxidant and antiproliferative activities of extracts of selected red and brown seaweeds from the Mandapam Coast of Tamil Nadu. J Food Biochem. 2014;38(1):92-101. doi:10.1111/jfbc.12029
25. Ganesan P, Kumar CS, Bhaskar N. Antioxidant properties of methanol extract and its solvent fractions obtained from selected Indian red seaweeds. Bioresour Technol. 2008;99(8):2717-2723. doi:10.1016/J.BIORTECH.2007.07.005
Received: September 26, 2022 / Accepted: October 15, 2022 / Published:15 February 2023
Citation: Valdez, A.; Choez, I.; Van Der Hende, S.; Ruíz, O.; Manzano, P. Condiciones óptimas de extracción de compuestos antioxidante del alga roja Acanthophora spicifera.
Revis Bionatura 2023;8 (1) 7. http://dx.doi.org/10.21931/RB/2023.08.01.11



















